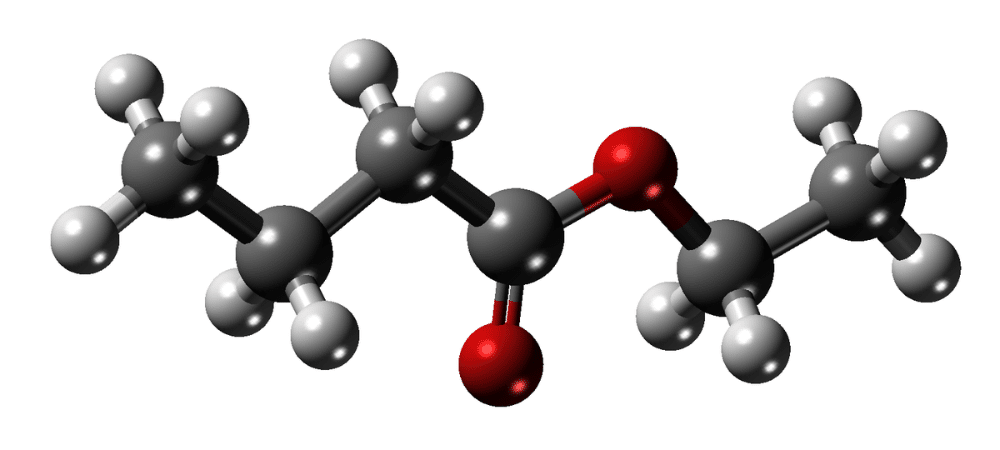
Plonge dans l’univers des composés organiques qui jouent un rôle central dans la chimie, la biologie, l’industrie et notre quotidien : les alcools, aldéhydes et cétones. Trois familles différentes, liées par la présence d’atomes d’oxygène dans leurs molécules, qui dévoilent un éventail fascinant de structures, de propriétés physiques, chimiques et de réactivités. Ces composés, parfois aux fragrances caractéristiques (penser à l’odeur des aldéhydes dans les fruits ou dans les parfums), parfois cachés dans la composition d’un médicament ou d’un solvant, manipulent la chimie des fonctions oxygénées avec finesse.
Cet article t’emmène dans un voyage rigoureux et ludique pour comprendre leurs structures, déchiffrer leurs propriétés physiques, décoder leurs mécanismes de réaction, et saisir leur importance dans le monde naturel et technologique.
Structure chimique : les bases et nuances
Les alcools : un groupe hydroxyle dans la lumière
Un alcool se caractérise par la présence d’un groupe fonctionnel hydroxyle (-OH) relié à un atome de carbone tétravalent sp³. La formule générale peut se représenter comme R−OHR-OHR−OH, où R est une chaîne ou un groupe alkyle.
- La chaîne carbonée peut être linéaire ou ramifiée.
- Les alcools sont classés en primaire, secondaire ou tertiaire selon le nombre de carbones liés au carbone portant le -OH.
Exemple :
- Éthanol (alcool primaire) : CH3−CH2−OH
- Isopropanol (alcool secondaire) : (CH3)2CHOH
Les aldéhydes : la pointe du carbonyle terminal
Les aldéhydes possèdent la fonction carbonyle (C=O) placée en bout de chaîne, attachée à un atome de carbone primaire. La formule peut se résumer par R−CHO
- Le carbone du carbonyle est sp², ce qui lui confère une géométrie plane.
- L’aldéhyde terminal est plus accessible et réactif que la cétone.
Exemple :
- Éthanal (acétaldéhyde) : CH3−CHO
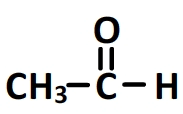
Les cétones : le carbonyle au cœur de la chaine
Les cétones ont également une fonction carbonyle, mais placée sur un carbone secondaire ou tertiaire au sein de la chaîne R−CO−R′.
- Plus stables que les aldéhydes, elles sont souvent moins réactives.
- Géométrie plane autour du carbone carbonyle, avec une polarité marquée.
Exemple :
- Propanone (acétone) : CH3−CO−CH3
Propriétés physiques : les effets du groupe oxygène
Solubilité dans l’eau
- Les alcools possèdent un groupe -OH polaire capable de créer des liaisons hydrogène avec l’eau, les rendant généralement bien solubles (surtout les petits alcools).
- Les aldéhydes et cétones, avec leur double liaison C=O polaire, interagissent aussi avec l’eau, mais leurs forces de liaison hydrogène sont moindres, donc ils sont souvent moins solubles que les alcools.
Points d’ébullition et de fusion
- Les alcools ont souvent des points d’ébullition plus élevés que les hydrocarbures de même masse molaire à cause des fortes interactions intermoléculaires (liaisons H).
- Aldéhydes et cétones ont des températures intermédiaires, supérieures aux alcanes mais inférieures aux alcools.
- La polarité et les interactions définissent aussi la viscosité et la tension superficielle.
Odeurs et états physiques
- Beaucoup d’aldéhydes ont des odeurs caractéristiques, souvent fruitées ou pénétrantes, utilisées en parfumerie.
- Les cétones tendent à avoir des odeurs plus douces, parfois sucrées.
- Les alcools varient, de l’odeur agréable de l’éthanol à des odeurs plus fortes et distinctes selon le nombre de carbones.

Réactivité chimique : les clés des transformations
Réactions caractéristiques des alcools
Les alcools, par leur groupe hydroxyle, peuvent subir plusieurs types de réactions importantes :
- Oxydation : un alcool primaire peut être oxydé en aldéhyde, puis en acide carboxylique. Un alcool secondaire peut être oxydé en cétone. (Ex : éthanol → éthanal → acide acétique)
- Substitution nucléophile : le groupe -OH peut être remplacé par un halogène, via des réactions avec des acides halogénés.
- Déshydratation : sous l’effet d’un acide, alcools peuvent perdre une molécule d’eau pour former des alcènes.
- Estérification : réaction avec un acide carboxylique pour former un ester (réaction de condensation).
Réactions spécifiques aux aldéhydes et cétones
- Réactivité du carbone carbonyle : le double lien C=O est électrophile, attirant les nucléophiles.
- Réduction : les aldéhydes peuvent être réduits en alcools primaires, les cétones en alcools secondaires.
- Réactions d’addition nucléophile : ajout d’ions cyanure, de bisulfite, ou d’alcools pour donner des composés stabilisés.
- Oxydation : les aldéhydes sont facilement oxydés en acides carboxyliques, contrairement aux cétones qui résistent à l’oxydation douce.
- Polymérisation et réactions en milieu basique ou acide (ex : réactions aldoliques).
Exemples concrets et applications dans la vie quotidienne
- Alcools : éthanol dans les boissons, solvants, antiseptiques. Glycérol en cosmétique.
- Aldéhydes : formaldéhyde pour la conservation des tissus, parfumerie (aldéhydes floraux), saveurs alimentaires.
- Cétones : acétone pour le dissolvant, corps cétoniques en métabolisme, arômes naturels.

Quiz : testons ta compréhension !
- Quelle est la principale différence structurale entre un alcool et un aldéhyde ?
- Donne un exemple d’alcool primaire et explique ce qu’il devient lors de son oxydation.
- Pourquoi les alcools ont-ils des points d’ébullition généralement plus élevés que les cétones ?
- Quel groupe fonctionnel est caractéristique des aldéhydes et des cétones ? Quelle est sa réactivité clé ?
- Explique pourquoi une cétone est moins facilement oxydée qu’un aldéhyde.
Réponses détaillées
- Différences entre alcool et aldéhyde : L’alcool possède un groupe hydroxyle (-OH), qui le rend capable de former des liaisons hydrogène et de participer à des réactions d’hydratation. L’aldéhyde, quant à lui, possède un groupe carbonyle (C=O) situé en bout de chaîne carbonée. Ce groupe confère à l’aldéhyde des propriétés réactives distinctes, en particulier en tant qu’électrophile dans les réactions de réduction ou d’addition.
- Oxydation de l’éthanol : L’éthanol (un alcool primaire) peut être oxydé en éthanal (un aldéhyde) grâce à un oxydant doux. L’éthanal, lorsqu’il subit une oxydation plus poussée, se transforme en acide acétique (un acide carboxylique), une réaction courante dans les processus de fermentation et de dégradation des alcools.
- Propriétés des alcools : Les alcools sont capables de former des liaisons hydrogène grâce à leur groupe –OH, ce qui augmente leur point d’ébullition par rapport aux hydrocarbures non polaires de taille similaire. Ces interactions moléculaires renforcent la cohésion entre les molécules d’alcool et nécessitent plus d’énergie pour être brisées, d’où l’élévation du point d’ébullition.
- Réactivité du groupe carbonyle : Le groupe carbonyle (C=O) est un groupe fonctionnel électrophile, c’est-à-dire qu’il attire les nucléophiles (molécules riches en électrons). Cela rend les aldéhydes et les cétones réactifs dans des réactions telles que l’addition nucléophile, où des réactifs comme l’eau, les amines ou les hydrides se lient au groupe carbonyle.
- Comparaison entre cétone et aldéhyde : La cétone diffère de l’aldéhyde par la position du groupe carbonyle : dans une cétone, le groupe carbonyle est situé à l’intérieur de la chaîne carbonée, ce qui le rend moins accessible aux réactifs. Cela explique pourquoi les cétones sont généralement plus résistantes à l’oxydation que les aldéhydes, où le groupe carbonyle est en position terminale et donc plus susceptible à l’attaque oxydante.
Ressources et approfondissements
- Tableaux des groupes fonctionnels et spectres IR pour identifier alcools, aldéhydes, cétones.
- Simulateurs 3D moléculaires (Avogadro, ChemSketch) pour visualiser leur structure.
- Vidéos éducatives sur les mécanismes d’oxydation et les réactions d’addition.
- Livres recommandés : Chimie organique de P. Bruice, Introduction à la chimie organique de J. McMurry.
Conclusion
Maîtriser la structure, les propriétés et la réactivité des alcools, aldéhydes et cétones, c’est ouvrir une fenêtre sur la diversité chimique qui façonne la nature et la technologie. Chaque famille, avec sa spécificité, son charme et ses applications, te permet de mieux comprendre les transformations chimiques et biologiques qui rythment notre monde. En chimie organique, ce sont ces composés oxygénés qui apportent une richesse d’usages et d’études sans fin.