La pile Daniell, véritable star des sujets du bac, est le modèle électrochimique par excellence pour comprendre le lien entre réactions chimiques, production d’électricité et applications concrètes. Grands principes, schémas, astuces méthodologiques, exercices corrigés et quiz interactifs : découvrez tout ce qu’il faut savoir pour maîtriser ce générateur et briller à l’examen.
Qu’est-ce qu’une pile Daniell ?
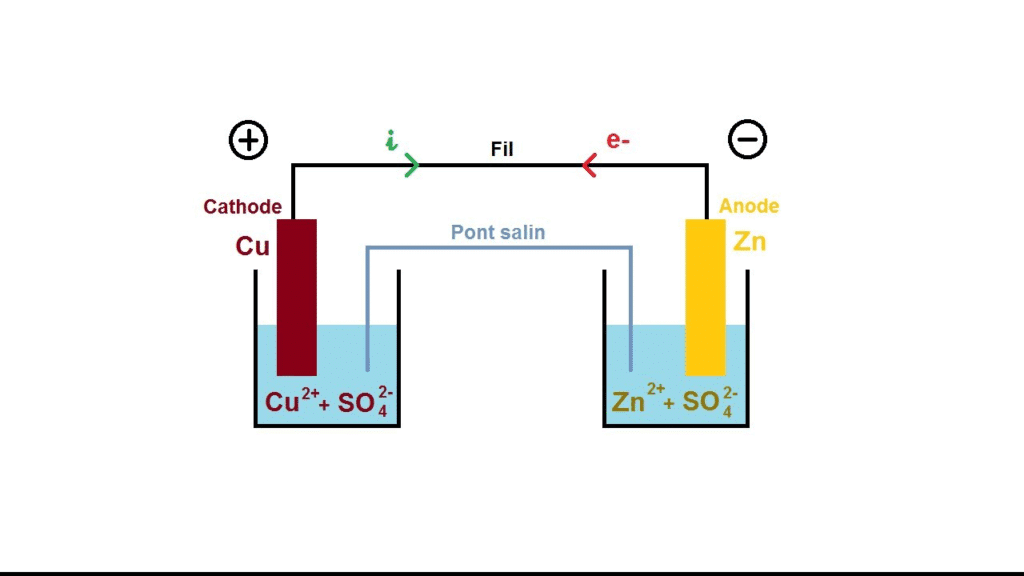
Définition : La pile Daniell est une pile électrochimique qui convertit l’énergie chimique d’une réaction d’oxydoréduction spontanée en énergie électrique. Elle est constituée de deux compartiments (ou demi-piles), chacun abritant une électrode (zinc et cuivre) plongée dans sa solution ionique, le tout relié par un pont salin permettant le passage des ions et la conservation de l’électroneutralité.
La pile Daniell met en jeu deux couples :
- Cu²⁺/Cu (cuivre)
- Zn²⁺/Zn (zinc)
Réaction globale : Zn (s)+Cu2+(aq)→Zn2+(aq)+Cu (s)
On dit que le zinc est oxydé et que le cuivre est réduit.
💡Remarque :
L’oxydoréduction est une réaction chimique dans laquelle se produit un échange d’électrons entre deux espèces. L’une, appelée réducteur, cède des électrons : elle est oxydée. L’autre, appelée oxydant, capte ces électrons : elle est réduite.
Ce mécanisme est au cœur de nombreux phénomènes naturels et technologiques, qu’il s’agisse de la respiration cellulaire, de la corrosion des métaux ou du fonctionnement des piles.
Dispositif expérimental schématisé
- Béchers (ou compartiments), l’un contenant une lame de zinc dans une solution de sulfate de zinc, l’autre une lame de cuivre dans une solution de sulfate de cuivre.
- Pont salin ou membrane poreuse reliant les deux solutions.
- Fils conducteurs reliés aux électrodes pour alimenter un circuit extérieur (ampèremètre ou lampe).
Démarche expérimentale : mode d’emploi pas à pas
a) Construction (résumé)
- Demi-pile de zinc : lame de zinc plongée dans une solution de sulfate de zinc.
- Demi-pile de cuivre : lame de cuivre plongée dans une solution de sulfate de cuivre.
- Les deux compartiments sont reliés par un pont salin (tube ou papier gélifié saturé en ions potassium/ nitrate, KCl ou KNO3, pour assurer la circulation des charges).
b) Fonctionnement : transformation chimique
- À l’anode (zinc) : Zn(s)→Zn2+(aq)+2e−
(oxydation : le zinc « donne » des électrons au circuit) - À la cathode (cuivre) : Cu2+(aq)+2e−→Cu(s)
(réduction : les ions cuivre « captent » les électrons et se déposent sur la lame)
Équation globale : Zn(s)+Cu2+(aq) → Zn2+(aq)+Cu(s)
Sens du courant, rôles des électrodes, polarité
- Anode (où a lieu l’oxydation) = Zinc (Zn) : pôle négatif (–)
- Cathode (où a lieu la réduction) = Cuivre (Cu) : pôle positif (+)
- Sens des électrons : du zinc (anode) vers le cuivre (cathode) à l’extérieur de la pile
- Sens du courant : inverse des électrons, du cuivre vers le zinc à l’extérieur
Astuces mnémotechniques :
- « Anode = Oxydation », deux voyelles
- « Cathode = Réduction », deux consonnes
Le pont salin et son importance
Le pont salin contient des ions qui assurent la neutralité électrique des solutions :
- Les cations migrent vers la cathode pour compenser la disparition des Cu2+ (réduction)
- Les anions se déplacent vers l’anode pour compenser l’accumulation de Zn2+ (oxydation)
- Sans le pont salin, la pile s’arrêterait très rapidement.
Calculer et interpréter la force électromotrice (f.e.m.) de la pile
La tension « à vide » mesurée entre les bornes (f.e.m.) se calcule par la différence des potentiels standards des deux couples :
E° = E°(cathode) – E°(anode)
Prenons l’exemple classique de la pile Daniell, qui met en jeu les couples Zn²+/Zn et Cu²+/Cu :
- Potentiel standard du couple Cu²+/Cu : +0,34 V
- Potentiel standard du couple Zn²+/Zn : –0,76 V
Le calcul de la f.e.m. donne donc :
E°pile = 0,34 – (–0,76) = 1,10 V
💡 Remarques :
- La f.e.m. dépend aussi des concentrations des ions (loi de Nernst).
- Lorsque la f.e.m. tombe à zéro, la pile est considérée usée : il n’y a plus de transfert d’électrons possible, le courant s’arrête.
Schéma conventionnel et symbolisation
Schéma à apprendre pour le bac :Zn(s) | Zn²⁺(aq, C1) || Cu²⁺(aq, C2) | Cu(s)
- La barre simple (|) sépare deux phases différentes, par exemple une phase solide (comme une électrode métallique) et une phase aqueuse (la solution contenant les ions).
- La double barre (||) représente le pont salin, qui permet aux ions de circuler entre les deux compartiments pour maintenir l’électroneutralité
- Anode à gauche, cathode à droite, comme dans l’écriture d’une équation redox.
Applications courantes en épreuve
- Identifier la nature de chaque électrode sur schéma ou manip.
- Écrire les demi-équations et l’équation bilan.
- Calculer la f.e.m. (tension maximale).
- Retrouver le sens du courant et des électrons.
- Expliquer ce qu’il se passe à la fin de vie de la pile (épuisement d’un réactif).
- Calculer la quantité max d’électricité délivrée Qmax = ne × F, où ne est le nombre de moles d’électrons échangées et F la constante de Faraday
- Calculer la durée de fonctionnement de la pile selon l’intensité Δt = Qmax / I
avec I en ampères (A) et Δt en secondes (s).
Astuces, points piège et méthodes d’expert
- Toujours équilibrer l’équation de la pile correctement.
- Repérer les espèces en solution (comme Zn²⁺ et Cu²⁺) et solides (Cu, Zn), et ne pas inclure les solides dans le calcul du quotient réactionnel.
- Se rappeler que l’électrode qui « fond » est l’anode (zinc ici, qui disparaît au cours du temps), l’électrode qui « grossit » est la cathode (cuivre se dépose).
- Le pont salin n’est pas un simple fil, il assure la neutralité des deux compartiments.
- Quand on branche la pile à un circuit consommateur, la f.e.m. diminue avec le temps, le zinc est consommé, la solution de cuivre pâlit puis les processus ralentissent et s’arrêtent.
En résumé :
| Élément | Donnée |
|---|---|
| Oxydation | Zn → Zn²⁺ + 2e⁻ |
| Réduction | Cu²⁺ + 2e⁻ → Cu |
| Réaction globale | Zn + Cu²⁺ → Zn²⁺ + Cu |
| Anode | Zinc |
| Cathode | Cuivre |
| Fém | 1,10 V |
Liens avec le programme et retombées concrètes
- Production d’énergie et durabilité : la pile Daniell illustre la conversion d’énergie chimique spontanée en énergie électrique, utilisable pour alimenter des appareils autonomes.
- Perspectives historiques : la pile Daniell a été cruciale pour le développement du télégraphe et comme pile de référence pour les mesures électriques.
- Préparation d’autres sujets : ce modèle s’applique à toutes les piles composées de couples redox et sert de point d’ancrage pour comprendre batteries, piles à combustible, accumulateurs, etc.
Exercice d’application guidé
Enoncé exemple :
Une pile Daniell fonctionne à partir de lames de zinc et de cuivre plongées dans leurs solutions respectives à 0,1 mol/L.
a) Écrire les demi-équations aux électrodes.
b) Quelle équation bilan ?
c) Quel est le pôle positif de la pile ?
d) Que se passe-t-il si on inverse les solutions ?
e) Calculez sa f.e.m. standard.
Réponses :
a) Oxydation (à l’anode) : Zn (s) → Zn²⁺ (aq) + 2 e⁻. Réduction (à la cathode) : Cu²⁺ (aq) + 2 e⁻ → Cu (s)
b) Équation bilan : Zn (s) + Cu²⁺ (aq) → Zn²⁺ (aq) + Cu (s)
c) Le pôle positif est la cathode, donc le cuivre.
d) Si on échange les solutions, on inverse la polarité : c’est le cuivre qui s’oxyderait (ce qui n’est pas spontané avec ces couples redox).
e) E° = +0,34 – (-0,76) = 1,10V.
Quiz interactif : Prêt pour le bac ?
- Où se produit l’oxydation dans la pile Daniell ?
- Que transporte le pont salin ?
- Donnez l’expression du schéma conventionnel d’une pile Daniell.
- Quelle espèce subit une réduction ?
- Comment évolue la masse des électrodes au cours du fonctionnement ?
- Quelle est la f.e.m. standard ?
Réponses :
- À l’anode (zinc)
- Les ions (pour maintenir la neutralité : cations et anions)
- Zn(s) | Zn²⁺(aq) || Cu²⁺(aq) | Cu(s) (la barre simple sépare l’électrode de sa solution ionique, la double barre représente le pont salin, qui relie les deux compartiments)
- Cu²⁺ subit une réduction, se dépose sur la cathode
- L’anode (Zn) diminue, la cathode (Cu) augmente
- 1,10 V (dans les conditions standard)
Conseils pratiques et points méthodologie : spécial bac
- Aux épreuves, lisez attentivement l’énoncé : identifiez toujours les couples redox et leur rôle (réducteur/oxydant).
- Pour les calculs, vérifiez bien unités et cohérence des valeurs : une f.e.m. négative signifie que la réaction ne peut pas se produire spontanément dans le sens choisi.
- Les schémas sont notés : soignez branchements, polarités, sens des flèches, légendes.
- Argumentez toujours vos réponses physico-chimiques par un raisonnement logique et l’appui sur la réaction globale.
Conclusion
La pile Daniell est bien plus qu’un exercice classique : elle est la clef pour comprendre tout le fonctionnement des générateurs d’électricité chimique du programme. En maîtrisant son schéma, ses réactions et ses applications pratiques, vous vous assurez un socle solide pour le bac.
Pour aller plus loin : testez vos connaissances sur les piles historiques, comparez le fonctionnement avec la pile Volta, puis explorez la question « pile ou accumulateur ? » (capacité, recharge, rendement) pour le grand oral ou le projet personnel.