Imagine-toi dans un laboratoire ou même dans la vie quotidienne : tu verses deux solutions aqueuses et soudain, un solide blanc apparaît, comme par magie, dans le mélange. Ce phénomène est l’une des manifestations les plus visibles d’une réaction chimique appelée réaction de précipitation. Mais derrière cette apparente simplicité se cache un ballet complexe d’ions, d’équilibres, et de lois chimiques régissant la formation de ce solide, nommé précipité. Comment identifier ce précipité ? Comment prédire sa formation avant même de réaliser le mélange ? Cet article s’adresse à toi, curieux et apprenant en terminale, pour explorer avec rigueur l’univers des réactions de précipitation.
On décryptera ensemble les mécanismes, les outils et les astuces indispensables à la maîtrise de ce chapitre crucial en physique-chimie.
Définir la réaction de précipitation : alliance et rupture dans une solution aqueuse
Une réaction de précipitation se produit lorsqu’on mélange deux solutions contenant des ions susceptibles de former un composé insoluble, ce composé étant appelé précipité.
Au démarrage, les ions sont dissous, mobiles, jouant leur rôle dans la solution. Mais si leur association forme un solide dont la solubilité est très faible, ce solide va se former et apparaître visiblement : le précipité. L’équilibre entre la phase dissoute et la phase solide s’établit, fournissant une image tangible d’un phénomène d’équilibre chimique.
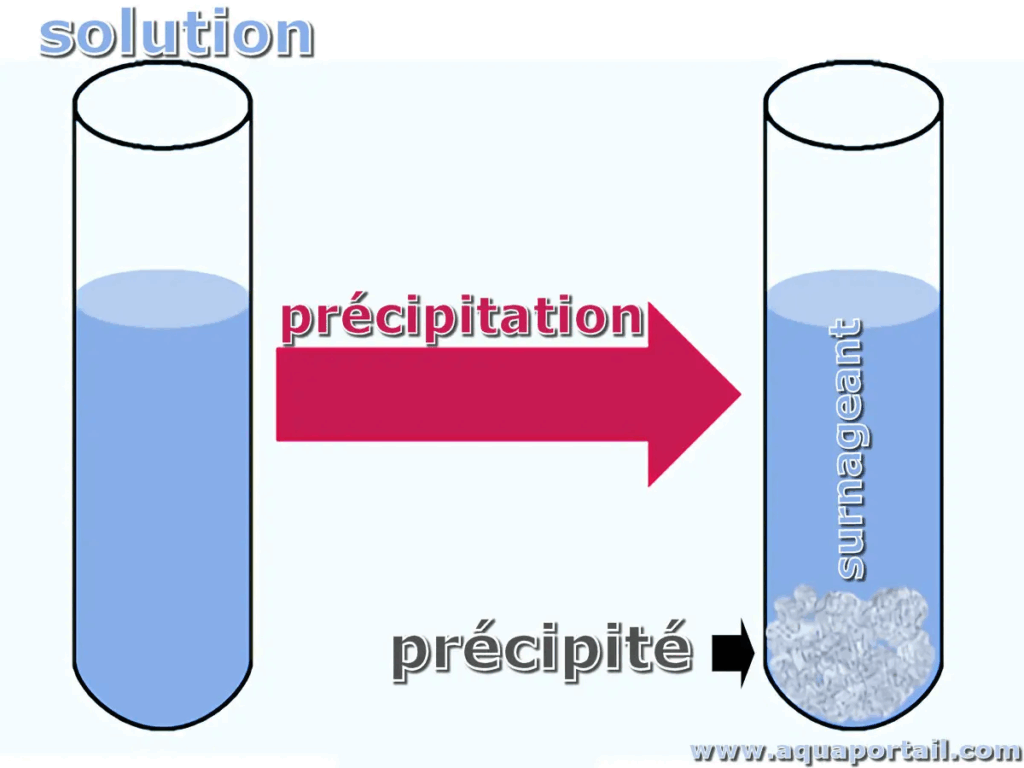
Exemple simple : la formation du chlorure d’argent (AgCl)
En mélangeant une solution d’argent nitrate (AgNO₃) avec une solution de chlorure de sodium (NaCl), les ions Ag⁺ et Cl⁻ présents en solution s’associent pour donner un solide blanc très peu soluble, l’AgCl, visible instantanément :
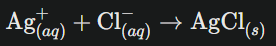
Le produit de solubilité (Ks) : la clé de la prédiction
Le concept essentiel
Pour prédire si un précipité va se former, il faut connaître la solubilité maximale du composé ionique dans l’eau, donnée par sa constante appelée produit de solubilité (Ks).
Prenons un composé ionique générale MxAy qui se dissocie ainsi :
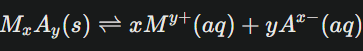
Le produit de solubilité s’exprime par :
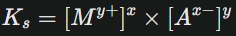
où les concentrations entre crochets sont celles des ions en solution à l’équilibre saturé.
Prédire la formation du précipité : le produit ionique (Q)
Quand tu mélanges deux solutions, tu peux calculer le produit ionique Q :
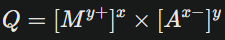
avec les concentrations initiales du mélange.
- Si Q>Ks, la solution est sursaturée : un précipité se forme.
- Si Q=Ks, la solution est à l’équilibre : proche de la saturation.
- Si Q<Ks, la solution est insaturée : pas de précipitation.
Ainsi, avant même de verser les solutions, tu peux prédire si un solide va apparaître !
Identifier les précipités à partir des règles de solubilité
Les règles générales de solubilité
Dans le monde ionique, certaines combinaisons forment quasi systématiquement des précipités. Voici quelques règles utiles :
- Sels solubles : nitrates (NO₃⁻), acétates (CH₃COO⁻), sulfates de Na⁺, K⁺, NH₄⁺ (avec exceptions).
- Sels peu solubles : halogénures d’argent (AgCl, AgBr), sulfures (S²⁻) hors des métaux alcalins, carbonates (CO₃²⁻) sauf Na⁺, K⁺, NH₄⁺.
- Hydroxyde (OH⁻) : bases souvent peu solubles sauf NaOH, KOH.
Ces règles te permettent d’anticiper quels composés vont former des précipités.
Application pratique pour des mélanges
Prenons encore l’exemple suivant :
BaCl₂ (aq) ⇌ Ba²⁺ (aq) + 2 Cl⁻ (aq)
Na₂SO₄ (aq) ⇌ 2 Na⁺ (aq) + SO₄²⁻ (aq)
Les ions présents sont : Ba²⁺, Cl⁻, Na⁺, SO₄²⁻.
BaSO₄ est faiblement soluble, donc il précipitera :
Ba²⁺ (aq) + SO₄²⁻ (aq) → BaSO₄ (s)
Cela te montre comment appliquer la théorie à des cas réels.
Mécanismes et étapes de la précipitation
De la dissociation à la nucléation
- Dissociation initiale : les ions en solution sont libres.
- Nucléation : formation des premiers petits agrégats ioniques.
- Croissance : agrégation des particules, apparition visible du solide.
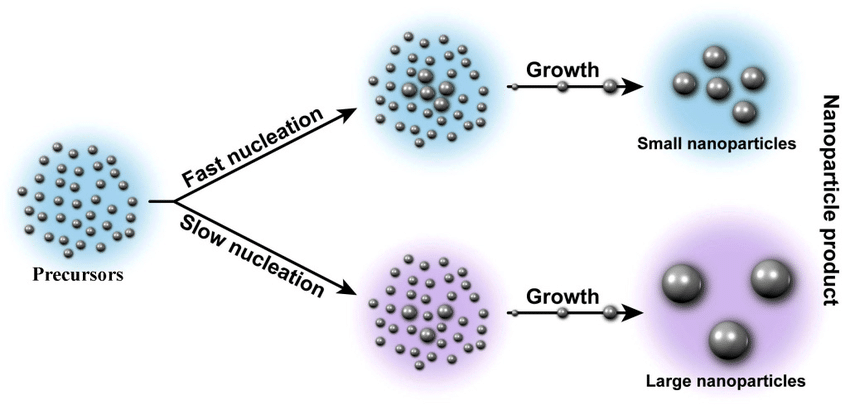
Selon les conditions (concentration, température, agitation), le précipité peut être plus ou moins fin, compact, ou colloïdal.
Rôle des paramètres physico-chimiques
- Température : influe sur Ks, modifiant la solubilité.
- pH : modifie la forme des ions (ex. hydrogénocarbonates), donc solubilité.
- Présence d’ions communs : diminue la solubilité (effet ion commun).
Applications concrètes et intérêt industriel
Contrôle de la qualité de l’eau
Les précipitations permettent de retirer des ions indésirables (ex. phosphates, métaux lourds) par addition d’un réactif formant un précipité peu soluble.

Analyse qualitative en chimie
Identifier un ion ou un métal en observant la formation de précipités caractéristiques est une technique fondamentale. Par exemple, la précipitation du AgCl blanc renseigne sur la présence de chlorures. Cette méthode permet de détecter avec précision des ions spécifiques dans des solutions complexes, facilitant ainsi l’analyse chimique qualitative.
Secteur pharmaceutique et biotechnologie
La solubilité et la précipitation contrôlées sont cruciales pour la fabrication de médicaments, où la forme cristalline et la pureté jouent un rôle majeur. Une compréhension précise de ces phénomènes permet d’optimiser l’efficacité des principes actifs et de garantir la stabilité des produits pharmaceutiques.
Cas pratiques et calculs pour préparer tes examens
Exemple de calcul
Mélange équimolaire de 0,01 mol/L de Ag+ et Cl− dans le même volume.
- Q=[Ag+][Cl−]=(0,005)2=2,5×10−5 (division par 2 car dilution par volume total doublé)
- Si Ks(AgCl)=1,8×10−10, comme Q>Ks, un precipité se forme.
Exercices recommandés
- Identifier le précipité formé en mélangeant deux solutions.
- Calculer Q et comparer à Ks.
- Étudier l’effet de la dilution ou d’un ion commun sur l’équilibre.
Quiz : vérifie ta compréhension !
- Qu’est-ce qu’une réaction de précipitation ?
- Comment peut-on prédire la formation d’un précipité avec Q et Ks ?
- Donne un exemple de précipité commun et son expression chimique.
- Pourquoi l’effet ion commun diminue-t-il la solubilité ?
- Cite une application industrielle des réactions de précipitation.
Réponses :
- C’est la formation d’un solide peu soluble à partir d’ions en solution aqueuse.
- Q > Ks, précipité se forme ; sinon non.
- Le chlorure d’argent : Ag⁺ + Cl⁻ → AgCl(s).
- La présence d’un ion déjà présent en solution limite la dissociation du solide.
- Purification de l’eau, analyse chimique, fabrication de médicaments.
Ressources pour aller plus loin
- Simulateurs en ligne : PhET Colorado (« Solubility and Precipitation ») pour visualiser les équilibres en temps réel.
- Fiches INRS et CNRS sur les produits chimiques et leurs précipités.
Conclusion : Maîtriser l’invisible, prédire le visible
La compréhension des réactions de précipitation dépasse la salle de classe : elle éclaire comment la matière se transforme dans la nature, dans l’industrie, et même dans ton corps. Repérer ces précipités, prévoir leur formation grâce au produit de solubilité, c’est s’armer d’un savoir stratégique, au carrefour de la théorie et de la pratique. Comme un détective de la chimie, tu sauras déchiffrer les indices invisibles qui annoncent la naissance d’un solide dans une solution !