Plonge-toi dans un verre d’eau fraîche auquel tu ajoutes quelques cristaux de sel. Tu constates leur disparition progressive. Mais où se cachent-ils ? Pourquoi certains solides semblent s’obstiner à rester intacts dans le fond, tandis que d’autres disparaissent totalement ? Ce ballet invisible, orchestré par la solubilité et le produit de solubilité « Ks », est au cœur de phénomènes aussi variés que la formation du calcaire, la purification des médicaments ou la beauté d’un stalactite.
Ce voyage te dévoile comment la chimie donne la parole aux ions, comment les équilibres interdisent parfois à une substance de se dissoudre totalement, et pourquoi, dans la nature comme au laboratoire, la « limite du possible » est codée par des nombres élégants.
Comprendre la solubilité : quand tout n’est pas soluble
La dissociation, une question d’équilibre
Imagine que tu ajoutes un solide ionique, par exemple du chlorure de sodium « NaCl », à de l’eau. Les ions « Na⁺ » et « Cl⁻ » se dispersent dans la solution, le solide semble s’effacer. Mais tous les sels n’ont pas la même facilité à s’évanouir : certains, comme le nitrate de potassium « KNO₃ », sont très solubles, d’autres, comme l’hydroxyde de cuivre(II) ou le chlorure d’argent « AgCl », à peine.
Cette quantité maximale qu’il est possible de dissoudre dans un volume d’eau à une température donnée s’appelle la solubilité. Son unité est généralement le g/L ou le mol/L. Elle dépend de la nature chimique, de la température, et parfois du pH lorsque l’ion réagit avec l’eau.
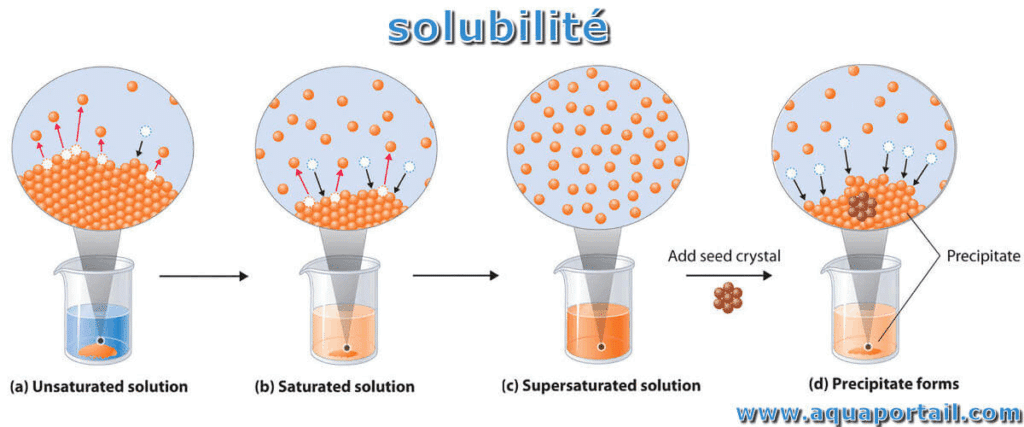
Saturation : l’équilibre du trop-plein
Lorsque tu ajoutes lentement un solide à l’eau, au début tout se dissout. Arrivé à un certain point, le solide reste au fond : la solution est saturée. L’équilibre s’établit alors entre la phase solide et les ions dissous.
Ce système est dynamique, mais stable : pour chaque ion qui quitte le solide pour l’eau, un autre « recristallise » au même rythme. Voilà la clé de l’équilibre de « saturation ».
Le produit de solubilité (Ks) : l’élégance d’un seuil invisible
Définition mathématique et principe fondamental
Le produit de solubilité – qu’on appelle aussi « constante de solubilité » et que tu noteras Ks – est la clé qui quantifie l’équilibre de saturation pour un solide ionique faiblement soluble.
Pour le sel d’équation générale :
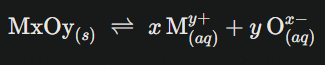
Le produit de solubilité Ks s’écrit alors :
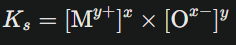
où les concentrations sont celles des ions en solution à l’état saturé, donc à l’équilibre, en « mol/L ». Le solide lui-même n’apparaît jamais dans Ks, car sa concentration ne varie pas pendant la dissolution.
Exemple concret : le chlorure d’argent « AgCl »
Équation de dissolution :
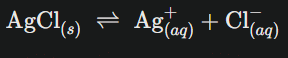
Le produit de solubilité sera :
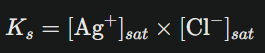
Sachant que pour chaque mole d’AgCl dissoute, un ion Ag⁺ et un Cl⁻ apparaissent à parts égales, donc si la solubilité est « s » mol/L alors : Ks=s2
Calculer la solubilité à partir de Ks : le plaisir des maths appliquées
Cas standard : solide du type AB
Exemple :
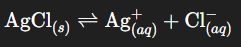
La constante de solubilité Ks est donnée par : Ks=s2
Si Ks=1,8×10−10 (valeur typique pour AgCl à 25°C), alors la solubilité s est calculée comme suit :

Cas général : un sel de type
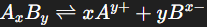
La constante de solubilité Ks est donnée par l’expression :
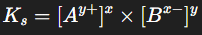
Si l’on pose s comme étant la solubilité en mol/L, alors :

Ainsi, la constante de solubilité devient :
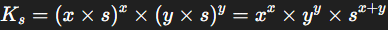
Ensuite, il suffit de résoudre cette équation pour s, en prenant soin des puissances.
Astuce
Plus le nombre de chaque ion est grand, plus la solubilité réelle (s) est faible pour un même Ks. C’est la magie des puissances : certains solides qui « libèrent » beaucoup d’ions ont une limite de solubilité très basse.
La solubilité dans le monde réel : contexte, couleur et contrôle
Nature fascinée par l’insoluble
C’est la faible solubilité du carbonate de calcium qui permet la formation des stalactites, des os et coquilles, ou encore des dépôts de calcaire dans ta bouilloire ! Les précipités insolubles jouent aussi un rôle critique en chimie analytique (ex : identification des ions argent via le précipité blanc d’AgCl).

Le rôle du pH : la dissolution modulée
Certains sels sont d’autant plus solubles que le pH varie. Exemple classique : l’hydroxyde de fer(III), Fe(OH)₃, insoluble à pH neutre, mais sa solubilité explose si l’on rend la solution acide. Ici, l’ion OH⁻ réagit avec les protons, faisant « tirer » la réaction vers plus de dissolution.
De même, l’ajout d’ions communs (comme ajouter du NaCl à une solution d’AgCl) fait « chuter » la solubilité par l’effet d’ion commun : l’équilibre se déplace pour limiter la concentration du nouvel arrivant.
Applications technologiques
Dans l’industrie, contrôler la solubilité est crucial pour la purification des substances (cristallisation), la formulation de médicaments (solubilité en milieu biologique) ou la protection contre la corrosion (précipitation contrôlée d’oxydes).
Quiz : pour valider tes acquis !
- Définis la solubilité d’un solide.
- Explique ce qu’est le produit de solubilité.
- Comment le pH peut-il influencer la solubilité d’un sel comme Fe(OH)₃ ?
- Peux-tu prévoir la formation d’un précipité en mélangeant deux solutions ? Donne un exemple.
Réponses :
- C’est la quantité maximale de soluté qui peut se dissoudre dans un solvant donné à température définie ; elle s’exprime en mol/L ou g/L.
- Le « produit de solubilité » est la constante d’équilibre qui relie la concentration des ions issus de la dissolution d’un solide faiblement soluble
- Plus la solution est acide, plus la solubilité de Fe(OH)₃ augmente, car les OH- sont consommés, l’équilibre évolue vers plus de dissolution.
- Oui : si le produit des concentrations ioniques dépasse Ks, un précipité se forme. Ex : Mélange de solutions contenant AgNO₃ et NaCl → précipité blanc d’AgCl.
Ressources à explorer pour aller plus loin
- Simulateurs « PhET Colorado » (« Salts & Solubility ») pour manipuler virtuellement la dissolution et l’apparition des précipités.
- Tableaux de Ks pour différents sels : disponibles dans ChemLibreTexts, Université de Strasbourg, ou sur les sites des académies nationales.
- Expériences à la maison : observation de la dissolution du sel, test de saturation avec du sucre ou du bicarbonate, précipitation du carbonate de calcium (vinaigre + craie).
- Vidéos YouTube de « ScienceEtonnante » ou « Expériences LaTeX » dédiées à la solubilité et aux équilibres ioniques.
Conclusion : Un équilibre entre visible et invisible
La solubilité et le produit de solubilité Ks orchestrent une grande partie des phénomènes qui régissent la nature et la technologie. Ils transforment le banal « fond de verre » en théâtre silencieux où se croisent dépôts précieux, couleurs vives, ou réactions explosives.
Maîtriser ces concepts, c’est décoder l’écriture cachée de la matière et acquérir la capacité de prédire, d’optimiser, d’imaginer : du cristal de roche au médicament, du traitement de l’eau à la géochimie des océans, la science de la dissolution fait partie intégrante de ton quotidien et du futur de la planète.