Bienvenue dans l’exploration approfondie de l’estérification, pilier de la chimie organique ! Analyser les tenants et aboutissants de cette transformation revient à maîtriser l’essence même des réactions de condensation et de liaisons moléculaires. Ce guide élargit la perspective scientifique, en mettant l’accent sur les principes physiques, la thermodynamique, le mécanisme réactionnel moléculaire, la cinétique, les conditions d’équilibre et l’intérêt des esters dans la recherche, l’industrie et la nature.
Définition de l’estérification : de quoi s’agit-il ?
Principes de base
L’estérification est une réaction chimique fondamentale où un acide carboxylique (R−COOHR−COOH) réagit avec un alcool (R′−OHR′−OH) pour former un ester (R−COO−R′R−COO−R′) et de l’eau (H2OH2O) :R−COOH+R′−OH⇌R−COO−R′+H2OR−COOH+R′−OH⇌R−COO−R′+H2O.
Ce processus correspond à une réaction de condensation qui expulse une petite molécule (ici l’eau) lors de la formation d’une liaison covalente entre les deux partenaires réactionnels.
Applications naturelles et industrielles
- Nature : Les esters abondent dans les arômes naturels, les huiles essentielles, les phéromones, les triglycérides (lipides naturels) chez les êtres vivants.
- Industrie : Production de solvants, plastifiants, parfums, anesthésiques locaux, agents tensioactifs, polyesters.
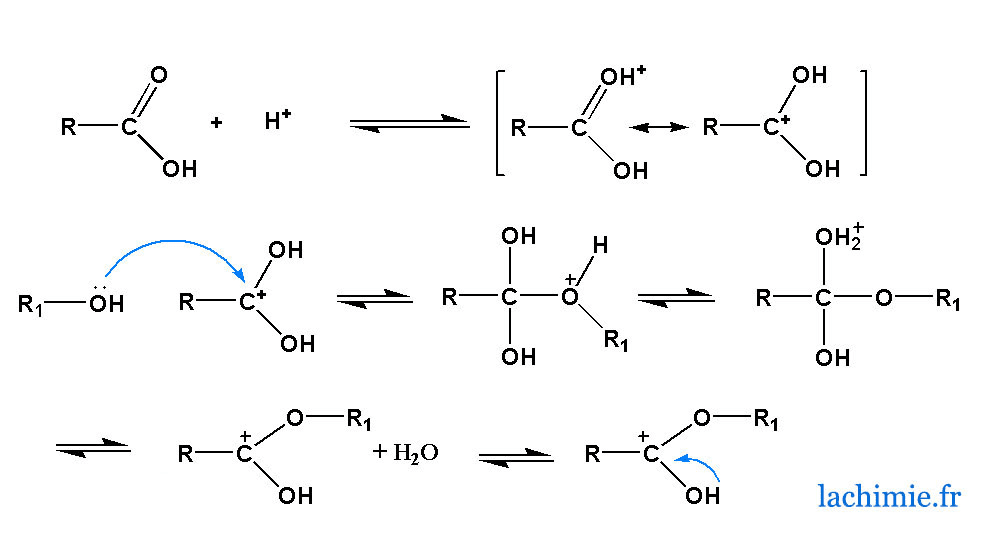
Étude mécanistique détaillée
Mécanisme de l’estérification de Fischer
Le mécanisme de Fischer, sous catalyse acide, est un modèle de réaction nucléophile-acide selon le schéma général :
- Protonation du carbonyle :
- L’acide fort (H2SO4H2SO4) protonne l’oxygène du groupement carbonyle, augmentant la polarisation de la double liaison C=O, rendant le carbone électrophile susceptible d’attaque.
- Attaque nucléophile :
- L’alcool (R′OHR′OH) attaque le carbone électrophile créant un intermédiaire instable (tétraédrique).
- Transferts de protons internes :
- Réarrangements qui préparent l’élimination de l’eau.
- Départ de l’eau :
- La formation d’eau favorisée par le transfert de proton permet l’obtention d’un oxonium (une molécule où l’oxygène porte une charge positive).
- Déprotonation finale :
- Récupération de la neutralité et obtention définitive de l’ester.
Représentation schématique
Chaque étape du mécanisme peut être suivie par la notation des flèches de déplacement d’électrons, les états de transition et intermédiaires réactionnels, visualisant précisément le rôle catalytique de l’acide.
Analyse thermodynamique : équilibre et rendement
Loi d’action de masse
La réaction d’estérification est majoritairement limitée par l’équilibre thermodynamique :Keq=[ester][H2O][acide][alcool]Keq=[acide][alcool][ester][H2O]
- La valeur de KeqKeq dépend de la nature des réactifs : généralement faible (sauf pour les esters très réactifs ou l’utilisation de dérivés d’acides).
- Pour déplacer l’équilibre : retirer l’eau (utilisation d’un piège à eau, distillation azeotropique) ou employer un excès d’un réactif.
Étude énergétique
- Variation d’enthalpie (ΔHΔH) : processus endothermique, favorisé par la température.
- Entropie (ΔSΔS) : faible car perte d’ordre (production d’eau).
- Gibbs (ΔGΔG) : Rend la réaction favorable seulement si l’eau est retirée ou l’un des réactifs est en excès.
Cinétique de l’estérification
- Lente à température ambiante : catalyse nécessaire.
- Activation énergétique : la protonation abaisse l’énergie d’activation.
- Équations cinétiques :
- Ordre dépendant de la concentration des réactifs et du catalyseur.
- Facteurs influents :
- Température : augmentation → vitesse accrue.
- Concentration d’acide catalytique (souvent 10-20% molaire).
- Nature de l’alcool ou de l’acide (plus il est encombré, moins la réaction est rapide).
Réactivité et sélectivité des substrats
- Acides carboxyliques dérivés (anhydrides, chlorures d’acyle) : donnent des esters avec rendements supérieurs car ils sont plus réactifs (non réversibles).
- Alcools secondaires et tertiaires : donnent un rendement plus faible en raison de l’encombrement stérique.
- Effet électronique : groupements électroattracteurs diminuent la réactivité des acides, alors que des donneurs d’électrons peuvent la faciliter.
Importance scientifiques et applications industrielles
Polymères et biochimie
- Polyesters : réactions d’estérification en chaîne à la base des plastiques comme le polyéthylène téréphtalate (PET).
- Triglcyérides (lipides naturels) : estérification naturelle d’acides gras et de glycérol, source d’énergie chez les êtres vivants.
- Voie de protection : en synthèse organique avancée, l’estérification sert à protéger les fonctions acides lors des séquences réactionnelles.
Industries et synthèses fines
La réaction d’estérification est largement exploitée dans l’industrie pour produire des esters, des composés aux propriétés variées et très recherchées. Voici les principales applications industrielles :
- Arômes et parfums : esters simples et mixtes pour les odeurs agréables, fruitées ou florales.
- Médicaments : modification de principes actifs (aspirine = acide acétylsalicylique, ester d’acide salicylique).
- Textiles et plastiques : fabrication de polyesters, présent dans les fibres synthétiques.
- Énergie : biodiesel par transestérification (huiles végétales + méthanol).
Tableau récapitulatif
| Acide | Alcool | Ester formé | Usage principal |
|---|---|---|---|
| Acide éthanoïque | Éthanol | Acétate d’éthyle | Solvant, parfum |
| Acide salicylique | Méthanol | Méthyl salicylate | Analgésique, arôme menthe |
| Acide benzoïque | Butanol | Benzoate de butyle | Solvant industriel |
Cas particuliers d’estérification et extensions
- Transestérification : remplacement d’une partie alcool d’un ester par un autre alcool, clé du biodiesel.
- Hydrolyse acide ou basique : la réaction inverse, très utilisée pour « découper » des esters (saponification des graisses).
- Estérification intramoléculaire : formation de lactones (cycles naturels ou synthétiques).
Nomenclature des esters
Pour nommer un ester, on remplace la terminaison « oïque » de l’acide carboxylique par « oate » suivi de la désignation de l’alcool sous forme de groupe alkyle.
Prenons un exemple :
- Acide éthanoïque + éthanol → Acétate d’éthyle (CH₃COOCH₂CH₃)
- Acide propanoïque + méthanol → Propanoate de méthyle
Vérifions vos acquis !
Donne la bonne réponse :
- Quel produit est formé lors d’une réaction d’estérification classique ?
- Quelle est la constante d’équilibre fondamentale de l’estérification ?
- Quel catalyseur est classique en estérification de Fischer ?
- Quel sous-produit accompagne toujours la formation d’un ester simple ?
- Pourquoi l’estérification n’aboutit-elle pas à 100% ?
- Quelle transformation spécifique est utilisée dans la production de biodiesel ?
- Pourquoi la réaction d’estérification est-elle réversible ?
Réponses :
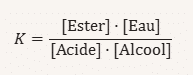
- Un ester + de l’eau
- K, donnée par :
- Acide sulfurique concentré
- Eau
- Équilibre réversible, compétition avec l’hydrolyse
- Transestérification
- Parce qu’on forme de l’eau, qui peut hydrolyser l’ester
Pour aller plus loin : Vidéo explicative détaillée – Mécanisme réactionnel de l’estérification. Une animation professionnelle pour visualiser toutes les étapes de l’estérification.
Conclusion : estérification comme pièce maîtresse de la chimie organique
Maîtriser la réaction d’estérification est fondamental pour naviguer avec aisance dans la chimie organique moderne. Qu’il s’agisse de comprendre la dynamique des liaisons, d’optimiser le rendement d’une synthèse ou d’explorer les applications biotechnologiques et industrielles des esters, une bonne connaissance des mécanismes réactionnels, des équilibres et des variables expérimentales s’avère décisive. Approfondir la compréhension scientifique de chaque étape – de la catalyse au contrôle de l’équilibre – permet d’aborder avec assurance la diversité des transformations organiques et des innovations de la chimie contemporaine.