Pourquoi la glace fond-elle au soleil ? Pourquoi l’eau « bouille » à 100°C dans ta cuisine et à 70°C en haut du Mont Everest ? Et que nous racontent exactement ces fameuses « courbes de changement d’état » vues en cours ? Allons au fond des choses, ou plutôt, des états de la matière !
Comprendre les changements d’état : un ballet moléculaire
Bienvenue dans le monde fascinant de la matière en transformation ! Derrière la fonte d’un glaçon, la vapeur d’une bouilloire ou la solidification du verglas se cachent des phénomènes universels, gouvernés par des lois précises… et des courbes charnières pour l’examen.
La matière, dans notre monde quotidien, se présente essentiellement sous trois états : solide, liquide et gazeux. Ce qui distingue ces états, ce n’est pas la nature chimique des substances, mais le comportement de leurs particules (atomes ou molécules) et l’énergie thermique qu’elles possèdent.
Les acteurs du changement : énergie et agitation
Prenons un glaçon dans un verre. Les molécules d’eau y sont fortement liées entre elles, formant un solide structuré. Si on chauffe le glaçon, on apporte de l’énergie thermique. Les molécules se mettent à vibrer de plus en plus… jusqu’à ce que les liaisons qui les maintiennent en place cèdent : c’est la fusion.
Encore plus de chaleur, et les molécules s’échappent dans toutes les directions : l’ébullition est en marche ! L’eau devient vapeur. Ce scénario, aussi simple soit-il, obéit à des lois précises.
💡 À retenir :
- La matière absorbe ou libère de l’énergie (chaleur) qui modifie l’arrangement des molécules sans en changer la nature. Donc lors d’un changement d’état, la composition chimique ne varie pas.
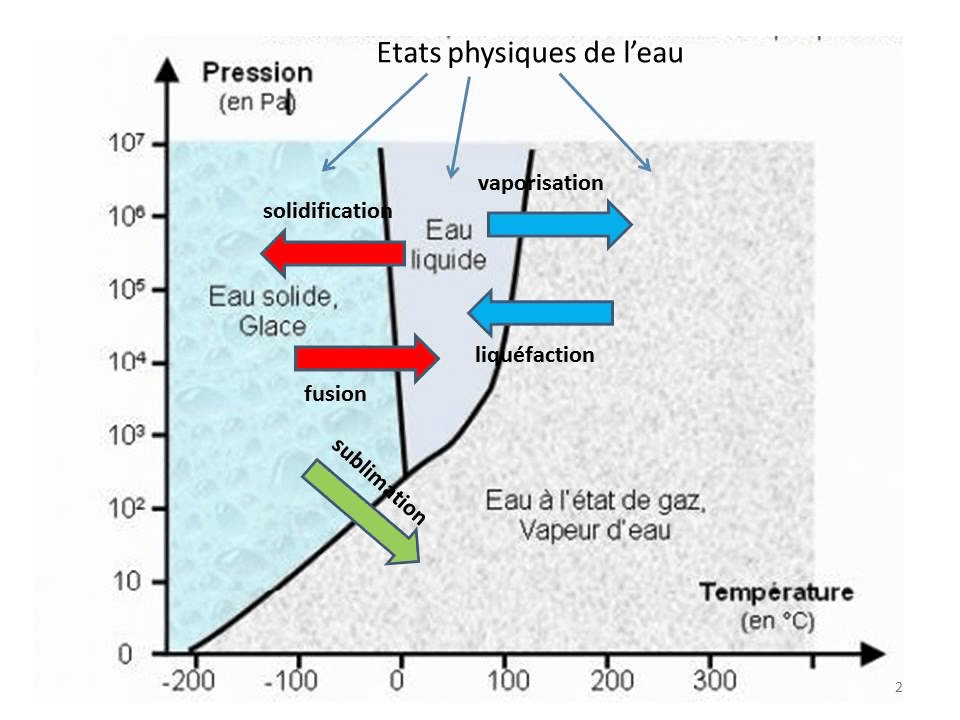
- Les exemples usuels de changements d’état sont la fusion (solide → liquide), l’ébullition (liquide → gaz), la solidification, la condensation, la sublimation et la déposition.
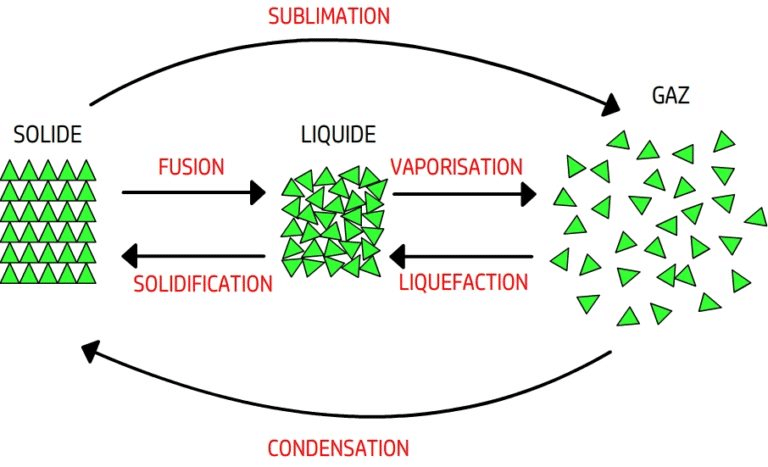
La fusion : le passage du solide au liquide
- Définition : la fusion est le changement d’état qui transforme un solide en liquide lorsque la température atteint une valeur clé, appelée température de fusion.
- Exemple : la fonte de la glace (H₂O(s) → H₂O(l) à 0 °C), la fusion du fer ou de l’or.
- Lors de la fusion, le solide absorbe de l’énergie qui permet aux entités chimiques (atomes, molécules) de vaincre les forces qui les maintenaient fixes, si bien qu’elles peuvent se déplacer.
👉🏻 Processus microscopique :
- Dans le solide, les molécules sont ordonnées et vibrent autour de leur position d’équilibre.
- À la température de fusion, l’agitation les libère partiellement : elles glissent les unes sur les autres, tout en restant en contact.
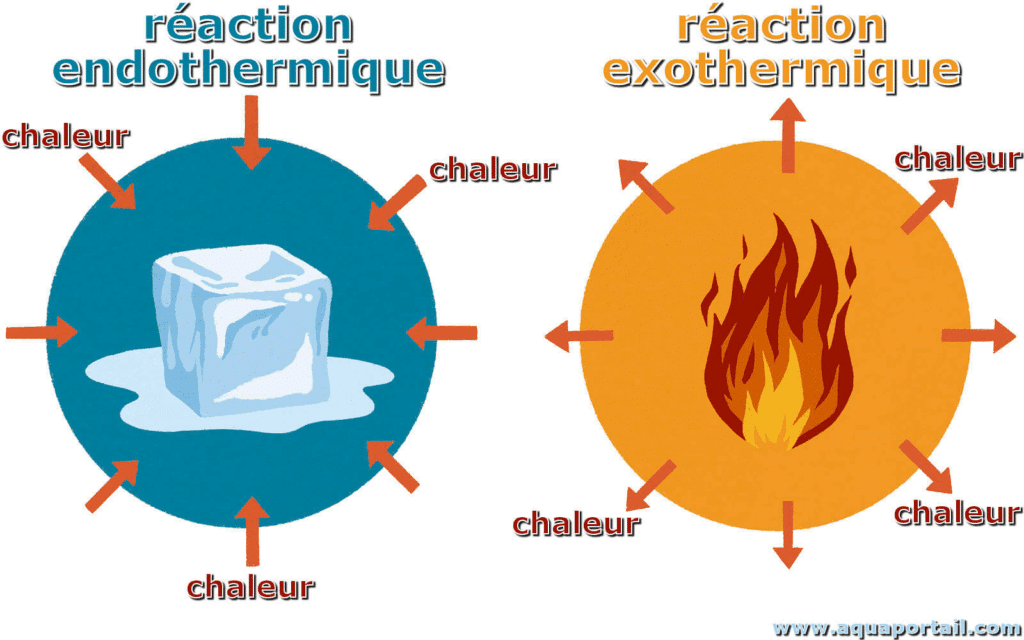
- Phénomène endothermique : la matière absorbe l’énergie de l’extérieur pour changer d’état.
L’ébullition : passage du liquide au gaz
- Définition : l’ébullition (forme de la vaporisation) est le passage de l’état liquide à l’état gazeux, réalisable à une température fixe appelée température d’ébullition ou point d’ébullition.
- Exemple : pour l’eau, l’ébullition démarre à 100 °C à la pression atmosphérique normale.
- Distinction :
- Ébullition : vaporisation rapide avec formation de bulles dans tout le liquide (ex. : eau qui bout).
- Évaporation : vaporisation lente, à température inférieure au point d’ébullition (ex. : linge qui sèche).

👉🏻 Processus microscopique :
- Les molécules du liquide se déplacent librement mais restent proches. À l’ébullition, elles reçoivent assez d’énergie pour rompre les liaisons intermoléculaires et devenir des molécules libres, très espacées, formant le gaz.
Les points de fusion et d’ébullition : des signatures physiques
- Point de fusion et point d’ébullition sont des propriétés caractéristiques d’une substance pure.
- Ils permettent d’identifier un composé et de juger de sa pureté (les impuretés modifient et élargissent souvent ces points).
👉🏻 Tableau d’exemples :
| Substance | Température de fusion (°C) | Température d’ébullition (°C) |
|---|---|---|
| Eau | 0 | 100 |
| Fer | 1535 | 2750 |
| Éthanol | -114 | 78 |
| Sel (NaCl) | 801 | 1465 |
Endothermique, exothermique : quelles différences ?
- Phénomène endothermique : la matière absorbe de l’énergie (fusion, vaporisation, sublimation).
- Phénomène exothermique : la matière libère de l’énergie (solidification, condensation, déposition).
Cette énergie, appelée chaleur latente, n’est pas utilisée à élever la température, mais à changer l’état.
Diagramme/courbe de changement d’état : lecture et interprétation
Le diagramme de changement d’état (ou courbe de chauffe/refroidissement) traduit l’évolution de la température d’une substance en fonction du temps pendant un chauffage ou un refroidissement à pression constante.
👉🏻 Déroulement typique pour l’eau :
- Segment 1 (solide) : T augmente, l’énergie reçue accroît l’agitation thermique.
- Plateau 1 (fusion à 0 °C) : la température reste constante, toute l’énergie sert à passer le solide en liquide.
- Segment 2 (liquide) : la T augmente, agitation moléculaire aussi.
- Plateau 2 (ébullition à 100 °C) : température constante, toute l’énergie reçue sert au changement liquide→gaz.
💡 Fait clé : La température reste constante pendant un changement d’état, même s’il y a apport de chaleur. Ceci caractérise un corps pur, alors qu’un mélange voit ses plateaux s’estomper ou s’élargir.
Loi énergétique : chaleur latente
Pour un changement d’état à température et pression constantes : Q=m×L
- Q = chaleur échangée (J)
- m = masse de la substance (kg)
- L = chaleur latente spécifique (fusion ou vaporisation) (J/kg)
👉🏻 Applications :
- Calcule la quantité d’énergie à fournir pour fondre un glaçon ou pour faire bouillir une quantité donnée d’eau.
- Au bac, cette formule est souvent mobilisée dans les exercices.
Applications et enjeux du quotidien
- Glace qui fond, eau qui bout, condensation sur les vitres, brouillard, givre : ces phénomènes reposent tous sur la fusion, l’ébullition et autres changements d’état.
- Industrie : distillation (ébullition/condensation), métallurgie (fusion/solidification), lyophilisation (sublimation).
- Écologie et climat : fonte des glaces et montée du niveau des mers, cycle de l’eau atmosphérique.
Erreurs fréquentes à éviter (spécial bac !)
- Confondre ébullition et évaporation.
- Croire que la température augmente pendant le changement d’état → FAUX pour un corps pur.
- Oublier que la vapeur d’eau existe partout même à température ambiante (évaporation).
- Négliger l’effet de la pression sur les points de fusion/ébullition (l’eau bout à moins de 100°C en altitude !).
Quiz : testons tes connaissances !
- À quelle température la glace fond-elle à pression atmosphérique normale ?
- Lorsqu’on chauffe de la glace à 0°C, que mesure-t-on pendant qu’elle fond ?
- Quelle(s) grandeur(s) caractérisent un changement d’état pour une substance pure ?
- Quelle est la différence énergétique entre la fusion et la solidification ?
- Quel changement d’état observe-t-on sur une vitre froide quand la buée apparaît ?
Réponses :
- À 0 °C.
- La température reste constante, c’est la quantité de chaleur absorbée qui augmente.
- La température de fusion ou d’ébullition, et la chaleur latente.
- Ce sont des phénomènes inverses : fusion = endothermique (absorption d’énergie), solidification = exothermique (libération d’énergie).
- Condensation de la vapeur d’eau (gaz → liquide).
Conseils méthodologiques
- Pratique régulièrement la lecture de courbes : repère les plateaux, relie-les aux températures de changement d’état.
- Repère les questions fréquentes au bac :
- calcul de chaleur latente
- identification d’un état à partir de la courbe
- impact de la pression.
Conclusion : vers une vision énergétique du monde
Comprendre la fusion et l’ébullition, c’est décoder l’une des faces les plus visibles de la physique, là où la matière change de visage sous l’action de la chaleur. À travers les courbes d’évolution, on lit en direct les signatures des corps purs. Plus qu’une connaissance académique, c’est une clé pour appréhender les phénomènes autour de nous, c’est la porte d’entrée vers des domaines fascinants :
- Géologie : que se passe-t-il au cœur des volcans ?
- Aérospatial : comment stocker des carburants à -253°C ?
- Industrie agroalimentaire : pourquoi surgeler à -18°C et pas -5°C ?