Comprendre les équilibres chimiques est fondamental pour tout(e) lycéen(ne) de filière scientifique. Mais derrière l’apparente simplicité d’une réaction « qui n’avance plus », se cachent des concepts puissants et des outils méthodologiques précis : le quotient de réaction en est le pilier. Que signifie-t-il ? Comment le calcule-t-on ? Pourquoi est-il si central pour maîtriser les réactions réversibles ? Suivez ce guide illustré pour percer tous les mystères de l’équilibre chimique !
L’équilibre chimique : comprendre le « repos » apparent des réactions
Dans un système fermé, certaines réactions ne s’arrêtent pas vraiment mais passent par un état d’équilibre dynamique : les réactifs se transforment en produits tout en laissant les produits se retransformer en réactifs, à vitesse égale.
- Exemple : La synthèse de l’ammoniac
N2(g)+3H2(g) ⇌ 2NH3(g)N2(g)+3H2(g)⇌2NH3(g) - À l’équilibre, les quantités de chaque participant restent constantes, même si les réactions « vont et viennent » en permanence.
Cet état d’équilibre dépend de multiples facteurs : la température, la pression, la concentration initiale, et la position de l’équilibre, caractérisée par le quotient de réaction puis la constante d’équilibre.
Quotient de réaction : définition et signification
👉🏻 Définition : le quotient de réaction, noté généralement Qr ou Q, caractérise l’état d’un système chimique à un instant donné.
Pour une réaction générique :
aA+bB ⇌ cC+dD
Le quotient de réaction s’écrit sous la forme :
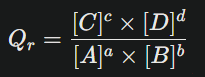
- Les crochets désignent les concentrations molaires (mol·L⁻¹)
- Les exposants sont les coefficients stœchiométriques de l’équation équilibrée
- C’est une grandeur sans unité, car chaque concentration s’annule mathématiquement.
👉🏻 Remarque :
- Si la réaction met en jeu uniquement des gaz, on peut exprimer Qr à partir des pressions partielles (quotient de réaction Qp), mais au bac, la version concentration molaire prime.
Calcul de Qr : explication visuelle
Exemple :
Considérons la réaction : H2(g)+I2(g) ⇌ 2HI(g)
À un moment donné tt, on mesure :
- [H2]=0,030 mol.L−1
- [I2]=0,020 mol.L−1
- [HI]=0,040 mol.L−1
On calcule :
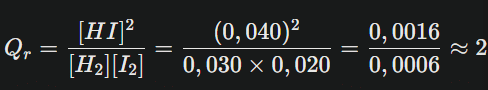
Cet instantané nous renseigne sur la « position » actuelle du système chimique, c’est-à-dire son décalage potentiel par rapport à l’état d’équilibre.
Le rôle capital du quotient de réaction dans la dynamique de l’équilibre
À quoi sert Q ?
- Comparer au « K » d’équilibre : à l’équilibre, Qr=K, où K est la constante d’équilibre, propre à chaque réaction et chaque température.
- Si Qr<K : Le système va « avancer » vers les produits (sens direct)
- Si Qr>K : Le système va « revenir » vers les réactifs (sens indirect)
- Si Qr=K : L’équilibre est atteint, les concentrations sont stables.
- Cela permet d’anticiper l’évolution d’un mélange nouveau ou d’un système perturbé.
En résumé
- Q = où vous en êtes maintenant
- K = où vous serez à l’équilibre à température donnée
Comparer les deux donne le sens d’évolution spontanée.
Comment écrire et utiliser correctement le quotient de réaction ? (méthode pas à pas)
Étapes clés :
- Écris l’équation-bilan équilibrée de la réaction (inclue les phases : (g), (aq), (s)…)
- Identifie les espèces à prendre en compte : seuls les gaz dissous et les espèces en solution sont pris, les solides purs et liquides purs n’entrent pas dans l’expression.
- Élève chaque concentration à la puissance correspondant au coefficient stœchiométrique.
- Place les produits au numérateur, les réactifs au dénominateur.
- Mesure/calcule chaque concentration, à l’instant voulu.
- Calcule le quotient :
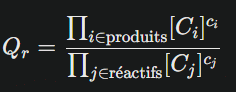
Exemple concret
Dissolution d’un sel dans l’eau NaCl(s) ⇌ Na+(aq)+Cl−(aq)
- Qr=[Na+][Cl−] (le solide n’apparaît pas)
Liens avec l’avancement, la stœchiométrie et la notion de réaction « totale »
Lorsque la réaction commence, seuls les réactifs sont présents, donc Qr est très faible. Plus elle avance, plus Qr s’approche de la valeur K. Pour certaines réactions très « déséquilibrées » (hydrolyse acide fort/base forte, précipitation complète), K devient tellement grand ou petit que l’on peut parler de réaction « quasi-totale ».
Dans les exos, on peut « suivre » l’évolution du système :
- On part des quantités initiales (n0), on introduit l’avancement (x), on calcule les concentrations à chaque instant, puis Qr.
Erreurs fréquentes et pièges à éviter
- Oublier d’équilibrer correctement l’équation chimique (vidéo à regarder si tu n’es pas encore très à l’aise avec cette étape clé !)
- Inclure un solide ou un liquide pur dans le quotient : seuls les gaz et espèces dissoutes figurent dans l’expression
- Mal écrire les puissances : ne pas oublier d’élever chaque concentration au coefficient stœchiométrique associé
- Confondre concentrations et quantités de matière : le quotient s’exprime toujours avec des concentrations (mol/L)
- Mélanger Q et K : on ne calcule Q qu’à un moment donné ; K ne varie qu’avec la température.
Application avancée : utiliser Q pour prédire l’évolution d’un système
Prenons un exemple typique : N2(g)+3H2(g)<=>2NH3(g)
Constante d’équilibre K=0,50 (pour une certaine température), concentrations initiales préparées sont données par :
- [N2]=0.20 mol/L
- [H2]=0.50 mol/L
- [NH3]=0.10 mol/L
Calcul du quotient :
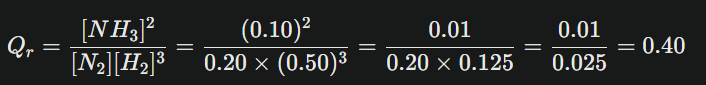
Ici, Qr=0.40<K=0.50 : le système évoluera vers les produits jusqu’à ce que Qr=K.
Quiz interactif : testez votre compréhension !
- Pour une réaction d’équation :A(aq)+2B(aq)⇌3C(aq) avec [A]=0.10 mol/L, [B]=0.20 mol/L, [C]=0.15 mol/L, calculez Qr.
- Si Qr<K, que fait le système ?
- Pourquoi ne faut-il pas inclure un solide pur dans l’expression de Qr ?
- À l’équilibre, que vaut Qr ?
Tu trouveras les réponses à la fin de cet article !
Conseils méthodologiques : pour briller le jour J
- Toujours partir d’une équation équilibrée et construire proprement le tableau d’avancement si besoin.
- Vérifier : unités (on travaille en mol/L), coefficients stœchiométriques, champ de définition (pas de concentration négative…).
- En cas d’autocritique ou de doute, relire/résoudre la question en sens inverse (testez vos résultats : si Qr=K, l’équilibre est bien respecté !).
Ressources utiles pour approfondir
Pour aller plus loin, n’hésite pas à jeter un coup d’œil sur cette stimulation interactive : PhET – Réactions à l’équilibre.
Conclusion : Q vous montre où vous êtes, K vous dit où aller !
Le quotient de réaction est un véritable GPS de la chimie : à chaque instant, il donne la position précise du système par rapport à son « point d’équilibre » (la constante K). En maîtrisant sa définition, sa méthode de calcul et son utilisation, vous décodez les dynamiques invisibles des réactions réversibles. Retenez surtout ce dialogue : Q vous montre où vous êtes, K vous dit où aller !
Maîtrisez ces outils, entraînez-vous avec des exercices types, et ni l’équilibre chimique, ni les sujets les plus complexes de la chimie du bac ne pourront plus vous résister !
Réponses au quiz :
- Qr = 0.844
- Il évolue spontanément vers la formation de produits (sens direct).
- Parce que les activités/concentrations d’un solide pur sont considérées comme constantes.
- Par définition, Qr=K.