En physique-chimie, la distinction entre mélange homogène et mélange hétérogène traverse notre vie quotidienne autant que les laboratoires de haut niveau. Fondamentale pour comprendre la matière autour de nous, cette notion éclaire la préparation des potages comme la fabrication des alliages industriels. Voici un guide complet qui inclut les définitions, les illustrations, les pièges à éviter et quiz interactifs, avec une attention particulière à l’ancrage dans notre quotidien et aux méthodes pratiques pour le bac.
Qu’est-ce qu’un mélange en chimie ?
Un mélange désigne une association physique (aucune transformation chimique) de plusieurs substances (composés ou éléments), chaque composant gardant ses propriétés propres.
- Il s’oppose à un corps pur, constitué d’une seule espèce chimique identifiable (ex. : eau distillée, fer).
- Contrairement à une transformation chimique (comme la combustion), ici les substances coexistent sans se modifier.
Dans un mélange, on parle de phases : une phase est une portion homogène, de composition et propriétés uniformes, physiquement délimitée.
Mélanges homogènes : invisibilité et uniformité
Définition
Un mélange homogène présente une seule phase visible, impossible à distinguer à l’œil nu : ses constituants sont répartis de façon uniforme, même si on grossit leur observation.
- À toute échelle accessible, un échantillon du mélange possède les mêmes propriétés (densité, couleur, goût, répartition chimique).
Exemples du quotidien
- Eau sucrée, eau salée (solution) : le sucre ou le sel se dissolvent totalement dans l’eau.
- Air atmosphérique : mélange gazeux constitué d’oxygène, d’azote, d’argon, etc.
- Jus de fruit sans pulpe, vinaigre blanc : la matière est dissoute de façon invisible.
- Alliages métalliques (ex. : bronze, acier) : mélange « homogénéisé » au niveau atomique.
- Alcool hydroalcoolique : éthanol et eau forment une solution uniforme.
- Sirop dissous dans l’eau, soda bien ouvert (avant dégazage du CO₂).
- Lait
À retenir : caractéristiques principales des mélanges homogènes
- Invisibilité des constituants : aucun composant n’est distinguable à l’œil nu.
- Stabilité : pas de décantation spontanée à l’échelle du temps courant.
- Uniformité : tout échantillon prélevé possède la même composition que le mélange global.
Remarque :
Il persiste un débat au sujet de certains mélanges, dont le lait : à l’observation courante, le lait est opaque et uniforme. Mais au microscope, c’est une émulsion, donc, parfois classée comme hétérogène. Plus d’explications ci-dessous.
Mélanges hétérogènes : visibilité, séparation et diversité
Définition
Un mélange hétérogène montre explicitement plusieurs phases ou composants : au moins deux de ses constituants sont discernables à l’œil nu ou au microscope. La composition n’est donc pas la même partout.
Exemples au quotidien
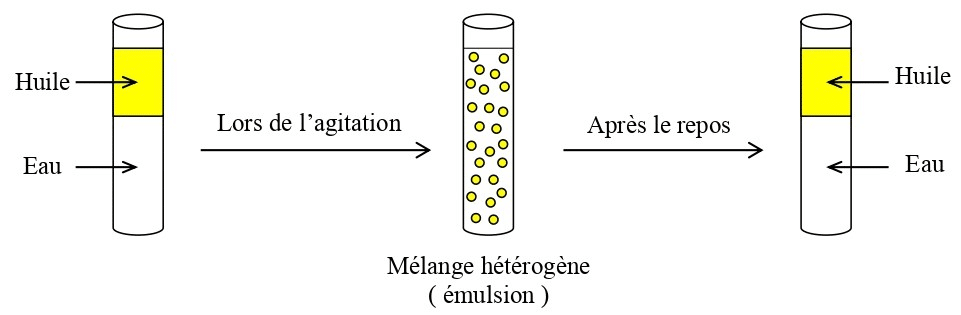
- Eau et huile/vinaigrette : l’huile flotte sur l’eau, phases visibles distinctement.
- Jus de fruits à pulpe, chocolat chaud avec dépôt, café moulu dans l’eau : pulpe, mousse ou dépôts sont d’autres phases, non uniformes.
- Eau boueuse, sable dans l’eau : les grains sont visibles, le liquide ne paraît pas uniforme.
- Lait caillé, fromage blanc : solides dispersés dans le liquide.
- Salade composée, mélange de noix, muesli : différents solides coexistent séparément.
- Fumée, aérosols, mousse : solide dans gaz, liquides dans gaz, gaz dans liquide…
- Solution saturée avec précipité : le surplus formant un dépôt.
Particularité : émulsions, mousses, gels
Certains mélanges, comme la mayonnaise, la crème fouettée ou la mousse au chocolat, semblent homogènes à première vue, mais ce sont des émulsions (dispersions de microgouttelettes dans un liquide) ou mousses (bulles de gaz dans un liquide ou un solide). Leur stabilité et leur aspect peuvent varier.
À retenir : caractéristiques principales des mélanges hétérogènes
- Présence de plusieurs phases visibles (ex. : bulles, couches, dépôts, particules).
- Non-uniformité à l’échelle de l’échantillon : si l’on prélève deux portions, leur composition différera souvent.
- Éventuelle décantation spontanée : séparation des phases avec le temps (ex. : huile qui remonte dans la vinaigrette).
Mélanges homogènes vs. hétérogènes : comment les distinguer expérimentalement

- Regarder à l’œil nu après agitation : distingue-t-on plusieurs couches, couleurs, dépôts ?
- Observation à la loupe, au microscope si besoin.
- Laisser reposer : se forme-t-il un dépôt ou une phase surnageante ?
- Essayez de filtrer : un filtre retient-il un solide, laissant passer un liquide limpide ?
- Test de stabilité dans le temps : une décantation, dépôt ou séparation apparaît-elle ?
Attention :
Parfois, il existe une frontière subtile. Certaines solutions sont homogènes jusqu’à une proportion limite (eau/sel jusqu’à saturation), ou dans certaines conditions (température, agitation).
Tableaux récapitulatifs
| Exemple du quotidien | Mélange homogène | Mélange hétérogène |
|---|---|---|
| Eau + sel (dissous) | ✔️ | |
| Eau + huile | ✔️ | |
| Lait (perspective « lycée ») | (✔️) | (cas particulier) |
| Jus de fruit sans pulpe | ✔️ | |
| Jus de fruit avec pulpe | ✔️ | |
| Air (atmosphère) | ✔️ | |
| Sable + eau | ✔️ | |
| Alliage (bronze, acier) | ✔️ | |
| Eau gazeuse (non secouée) | ✔️ | |
| Eau gazeuse (bulles apparentes) | ✔️ |
Pièges, cas frontières et subtilités
- Le lait : homogène à l’œil nu, mais micro-hétérogénéité sous le microscope. Pour le bac, on accepte homogène, sauf consigne spéciale.
- Solutions saturées : si tout le sel ne se dissout plus, l’excédent fait un dépôt → hétérogène.
- Le vinaigre (acide acétique dans l’eau) ou sodas : homogènes à l’achat, peuvent devenir hétérogènes si bulles ou dépôts apparaissent (à l’ouverture, par agitation, ou en vieillissant).
- Émulsions et gels : stabilité et taille des particules déterminent leur « homogénéité » perçue.
- Pression et température : elles influent sur la miscibilité (ex. : eau/gaz, solutions gaz/liquide sous pression).
Les états physiques : solide/liquide/gaz dans les mélanges
- Solide dans liquide : sel dissous (homogène), sable (hétérogène).
- Liquide dans liquide : alcool dans l’eau (homogène), huile dans eau (hétérogène).
- Gaz dans liquide : O₂ dans eau du robinet (homogène), CO₂ qui s’échappe, formation de bulles (hétérogène s’il y a dégagement visible).
- Gaz dans gaz : toujours homogène (air).
- Solide dans solide : alliages (homogène), mélange de poudre de sucre et de sel (hétérogène sauf dissolution).
Mélanges : propriétés et applications pratiques
- Saveur, couleur, odeur uniformes dans un homogène ; non uniformes dans un hétérogène.
- Industrie alimentaire : dosage précis des composants, clarification, filtration.
- Médecine et pharmacie : importance de la stabilité et homogénéité des solutions et suspensions.
- Environnement : pollution de l’air (homogène), eaux usées (hétérogènes).
- Matériaux : fabrication d’alliages, ciments, mousses, peintures.
Pour aller plus loin : quelques expériences ludiques
- Dissolvez du sel ou du sucre dans de l’eau, puis filtrez : rien ne reste sur le filtre car tout est dissous (homogène).
- Ajoutez de l’huile à l’eau, mélangez, puis laissez reposer : l’huile remonte, deux couches nettes se voient (hétérogène).
- Secouez une boisson gazeuse et observez la formation de bulles : si bulles visibles, mélange devient hétérogène.
- Mélangez du poivre ou de la terre à de l’eau : phase solide reste visible, l’eau est trouble (hétérogène).
Quiz : testez vos connaissances !
- Que voit-on à l’œil nu dans un mélange homogène ?
- La soupe de légumes « mixée » est-elle homogène ou hétérogène ?
- Mélange-t-on de l’air et du dioxyde de carbone : quel type de mélange ?
- L’eau de mer claire, homogène ou hétérogène ?
- Pourquoi le jus d’orange à pulpe se sépare-t-il après repos ?
Réponses :
- Une seule phase ; les différents constituants sont invisibles.
- Généralement hétérogène (petites particules résiduelles), mais peut sembler homogène selon le broyage.
- Homogène (gaz miscibles).
- Homogène (sels dissous invisibles).
- Les particules solides de pulpe, plus lourdes que l’eau, tombent au fond (hétérogène par séparation des phases).
Conseils méthodologiques pour le bac
- Toujours commencer par observer l’aspect du mélange (œil nu/loupe/microscope).
- Appuyez-vous sur des critères simples : nombre de phases, uniformité, stabilité dans le temps (au bac : un mélange est homogène si pas de séparation visible, sauf consigne particulière)..
- En cas de doute, argumentez (taille des particules, mode de préparation…).
Conclusion : les mélanges, c’est pas sorcier !
Savoir distinguer, conceptualiser et illustrer mélanges homogènes et hétérogènes, c’est saisir une clé essentielle de la matière et des techniques scientifiques, mais aussi de la vie de tous les jours : cuisine, environnement, santé, industrie. L’essentiel : observer, raisonner et argumenter, en puisant dans les exemples autour de vous. La rigueur et la curiosité sont vos meilleurs alliés : au laboratoire comme dans la vraie vie.
Et la prochaine fois que vous préparez un chocolat chaud ou un sirop à l’eau, regardez bien : vous êtes déjà en train de faire de la chimie !