Imagine un monde où eau, air, roches, organismes vivants, produits ménagers et nutriments dialoguent sans cesse à coup d’échanges ioniques. Cette orchestration muette s’opère grâce à des acteurs phares : les acides et les bases. Qu’ils soient forts ou faibles, ils gouvernent l’équilibre des milieux, la vitesse de réactions, la saveur de nos aliments, et régissent même la physiologie cellulaire. Pourtant, derrière cette familiarité chimique, se cache une subtilité magistrale : celle de la force et de la faiblesse.
Qu’est-ce qui fait la différence entre un acide fort et un acide faible ? Pourquoi la distinction est-elle cruciale pour comprendre la nature, l’industrie et, parfois, la vie elle-même ? Cet article te propose une exploration vivante et interactive de ce pan fondamental de la chimie.
Genèse des concepts d’acide et de base : définition et repères historiques
L’acide et la base : des intuitions antiques à la rationalisation moderne
L’histoire commence bien avant Lavoisier. Déjà, les alchimistes reconnaissaient les saveurs piquantes des « esprits » (acide sulfurique) et les propriétés caustiques des cendres (« bases »). Mais c’est au XVIIIe siècle, puis avec Arrhenius, Brønsted et Lowry au début du XXe, que naissent nos définitions modernes.
- Acide : espèce chimique capable de céder un proton H⁺ (Brønsted-Lowry).
- Base : espèce chimique capable de capturer un proton H⁺.
Cette approche, élégante et universelle, s’épanouit en solution aqueuse, mais pousse vers d’autres généralisations : acides et bases de Lewis, où le jeu porte sur le transfert d’un doublet d’électrons (plus utile en chimie organique et minérale avancée).
La force d’un acide ou d’une base : une affaire d’équilibres
Dissociation, équilibre et constante d’acidité
Plonger un acide dans l’eau, c’est lui proposer un défi : va-t-il, ou non, lâcher ses protons aux molécules d’eau ? De sa propension à relever ce défi naît la notion de force.
- Un acide fort se dissocie totalement : dès qu’il touche l’eau, il cède tous ses protons. Aucun retour en arrière n’est possible à l’échelle macroscopique.
- Un acide faible, au contraire, hésite : il partage sa population entre la forme dissociée (anion + H₃O⁺) et la forme non dissociée.
Le phénomène est identique pour les bases.
La force d’un acide ou d’une base s’exprime par une grandeur fondamentale : Ka=[A−][H3O+]/[AH]
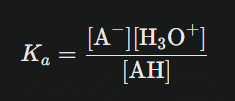
où Ka : constante d’acidité ; [A⁻] : concentration de la base conjuguée, [H₃O⁺] : concentration en ions hydronium, [AH] : concentration d’acide non dissocié.
Un Ka élevé (ou un pKa faible) marque un acide fort. Inversement, plus le pKa est élevé, plus l’acide est faible.
Tableaux de force : quelques repères
| Acide ou base | Comportement en solution | pKa ou pKb typique |
|---|---|---|
| Acide chlorhydrique (HCl) | Fort | pKa ≈ -6 |
| Acide sulfurique (H₂SO₄, 1ère dissociation) | Fort | pKa ≈ -3 |
| Acide acétique (CH₃COOH) | Faible | pKa ≈ 4,8 |
| Ammoniac (NH₃) | Faible base | pKb ≈ 4,8 |
| Soude (NaOH) | Forte base | pKb ≈ -0,2 |
| Eau | Amphotère | pKa ≈ 15,7 |
La distinction n’est pas purement académique : elle détermine la conductivité électrique, la force du pH obtenu, la possibilité d’inverser la réaction par le simple jeu du dilution ou de la neutralisation.
Acides forts et faibles : un affrontement d’exemples
Les acides forts
Ils sont peu nombreux, mais fondamentaux en laboratoire et en industrie :
- HCl (acide chlorhydrique)
- HNO₃ (acide nitrique)
- H₂SO₄ (acide sulfurique, 1ère dissociation)
- HBr (acide bromhydrique)
- HI (acide iodhydrique)
- HClO₄ (acide perchlorique)
Ils se dissocient à 100 % : une solution de HCl 1 mol/L contient effectivement 1 mol/L de H₃O⁺.
Les acides faibles
Ici, la diversité règne : acide acétique (CH₃COOH), acide formique (HCOOH), acide cyanhydrique (HCN), acide fluorhydrique (HF), acides organiques des fruits.
À titre d’exemple, une solution d’acide acétique 1 mol/L ne produit qu’environ 0.0042 mol/L de H₃O⁺ : seuls 0,42 % des molécules « osent » céder leur proton.
Les bases fortes
- Soude (NaOH) et potasse (KOH) donnent 100 % d’ions OH⁻.
- L’ion oxyde (O²⁻) : base extrême, très rare en solution aqueuse, réagit violemment avec l’eau.
- L’ammoniac (NH₃) reste une base faible, très usuelle en laboratoire (pKb ≈ 4.8).
Applications et implications concrètes
pH : l’échelle clé pour mesurer l’action
Rappelons-nous que : pH=−log[H₃O⁺]
Le pH d’une solution d’acide fort est directement déductible de sa concentration ([H₃O⁺]=C), alors que celui d’un acide faible nécessite de résoudre l’équation quadratique tenant compte de la dissociation partielle.
Importance pour la titration et le contrôle des milieux
Les solutions d’acides ou de bases forts servent de standards pour titrer (déterminer la concentration) d’autres solutions par neutralisation, grâce à la réaction rapide et complète.
Au contraire, les solutions faiblement acides ou basiques amortissent les perturbations de pH : ce sont les fameux “tampons”, omniprésents en biologie (rôle du couple H₂CO₃/HCO₃⁻ dans le sang), dans la mer, dans les sols.
Digressions vivantes : la nature, experte des équilibres faibles
Le citron (acide citrique) pique la langue grâce à son acidité faible, tandis que la soude caustique, dégraissant ménager, est à manier précautionneusement sous peine de brûlures graves.
Dans l’organisme, le maintien du pH sanguin (7,4) est vital : trop acide ou trop basique, c’est la survie en jeu. Les tampons naturels protègent chaque cellule, chaque organe, preuve que la force absolue peut être dangereuse là où la faiblesse maîtrisée fait la vie.
Problématiques clés : dilution, influence du solvant, force relative
Influence de la dilution
Ajouter de l’eau à une solution d’acide faible favorise sa dissociation : le pourcentage d’ions libérés augmente, même si la concentration totale en ions H₃O⁺ diminue. Un acide fort, lui, reste totalement dissocié.
Influence du solvant
Si l’on remplace l’eau par l’acide sulfurique pur ou par l’ammoniac liquide, le comportement change du tout au tout : un acide fort (tel que HCl) dans ces milieux peut devenir faible. La force dépend donc de la capacité relative du solvant à accepter ou céder des ions.
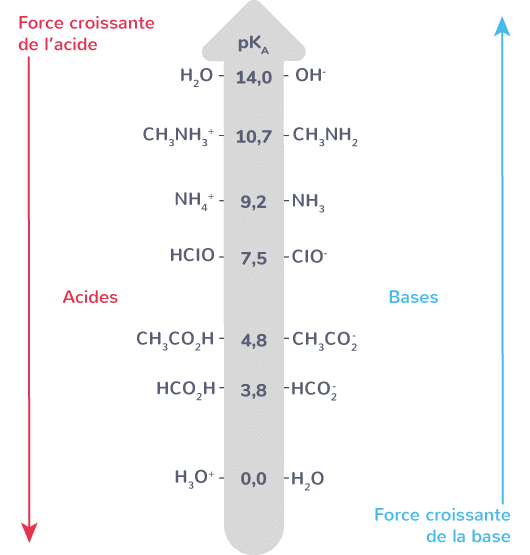
Couples acide/base conjugués : la danse de l’équilibre
À chaque acide correspond une base conjuguée. Ainsi, l’acide acétique (CH₃COOH) donne l’ion acétate (CH₃COO⁻). Plus un acide est fort, plus sa base conjuguée est faible, et inversement, une logique élégante, bâtie autour de la conservation du proton et des subtilités des équilibres chimiques !
Limites et perspectives expérientielles
La frontière fort/faible dépend du contexte : certains composés se comportent différemment selon le solvant, la température ou la pression. Les titrages nécessitent, pour être interprétés finement, la maîtrise des équilibres, de la stœchiométrie et, parfois, de la chimie quantique pour les cas exceptionnels (HF notamment).
Quiz : testons tes connaissances !
- Qu’est-ce qui distingue fondamentalement un acide fort d’un acide faible en solution aqueuse ?
- Citez un exemple d’acide fort et un d’acide faible, de base forte et de base faible.
- Pourquoi un acide faible est-il essentiel à la survie physiologique, là où un acide fort peut être dangereux ?
- Quel est le rôle d’un système tampon dans le sang ?
- Distinguez, par un calcul de pH, la solution 0,1 mol/L d’HCl de celle de CH₃COOH à la même concentration (pKa = 4,8).
Réponses
- L’acide fort se dissocie totalement, l’acide faible partiellement.
- HCl (fort) vs acide acétique (faible) ; NaOH (forte base) vs NH₃ (faible base).
- Les acides faibles tamponnent les variations de pH, les forts créent des conditions extrêmes peu compatibles avec la vie.
- Il amortit les variations de pH en capturant ou libérant H⁺ selon les besoins.
- HCl : pH = 1. Acide acétique : pH ≈ 2,9 (calcul à partir de l’équation du Ka).
Ressources à explorer : pour aller plus loin
- Animations interactives : PhET Colorado (« Acid-Base Solutions », « pH Scale »).
- Livres : John McMurry « Chimie organique », Atkins & de Paula « Principes de chimie ».
- Chaine YouTube « ScienceEtonnante » (vidéos sur le pH, la chimie du vivant).
Tableau de pKa détaillé
| Acide | pKa | Base conjuguée |
 | -10 | 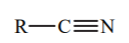 |
| HBr | -9 | 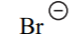 |
| HCl | -7 | 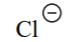 |
| HO-SO3H (H2SO4) | -10 | 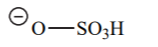 |
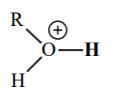 | -2 | 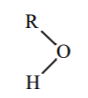 |
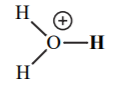 | -1.7 |  |
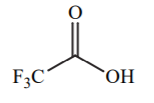 | 0 | 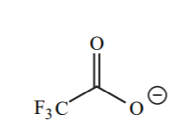 |
| HF | 3 | 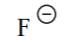 |
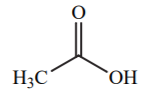 | 5 |  |
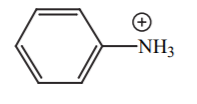 | 4-5 |  |
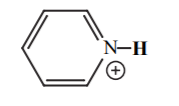 | 5 | 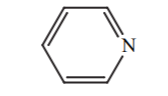 |
| H2CO3 | 6.4 | 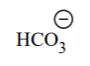 |
| H2S | 7 | 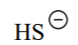 |
| HCN | 9.2 | 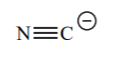 |
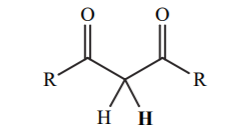 | 9 | 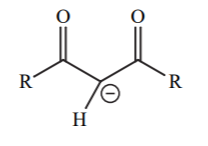 |
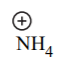 | 9.2 | H3N |
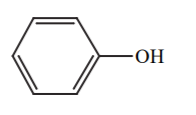 | 10 | 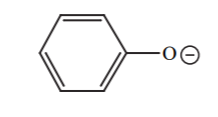 |
| RSH | 11 | 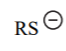 |
| H2O | 15.7 |  |
| ROH (alcohols) | 16-17 |  |
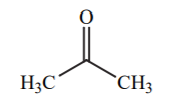 | 20 | 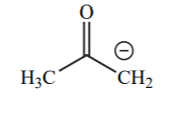 |
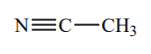 | 25 |  |
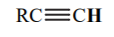 | 25 | 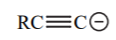 |
| NH3 | 38 | 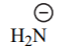 |
| ArCH3 | 40 | 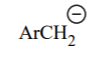 |
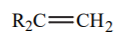 | 44 | 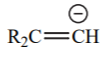 |
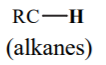 | ~ 48–53 | 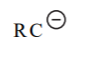 |
Conclusion : La force de la nuance en chimie
Maîtriser la différence entre acides et bases forts ou faibles, ce n’est pas simplement connaître des formules : c’est accéder au langage secret de la transformation de la matière, de la saveur du citron à la composition du sang, du titrage en laboratoire à la composition des océans et à la fabrication des médicaments !