« Je ne comprends rien à ce tableau… Pourquoi on met zéro ici ? Et c’est quoi ce x qu’on fait bouger partout ? » Si toi aussi tu t’es déjà posé ces questions devant des tableaux d’avancement, cet article est pour toi.
Pour aborder les réactions chimiques avec rigueur, surtout au lycée, l’outil incontournable s’appelle tableau d’avancement. Plus qu’un simple tableau de calculs, c’est une carte d’identité dynamique de votre transformation chimique, qui structure la pensée et permet d’éviter la majorité des erreurs d’interprétation ou de calcul lors des exercices ou TP.
Ce guide illustré te dévoile la méthode infaillible pour construire, compléter et exploiter le tableau d’avancement pas à pas, tout en déjouant les pièges classiques. Au programme : explications détaillées, applications, astuces, quiz interactif, et ressources pour briller au bac et au-delà.
Qu’est-ce qu’un tableau d’avancement ? Pourquoi est-il indispensable ?
En chimie, lorsqu’une réaction chimique a lieu, les réactifs disparaissent petit à petit, et les produits apparaissent. Pour suivre cette transformation, on utilise une méthode systématique : le tableau d’avancement.

⚠️ Mais attention : cet outil, aussi puissant soit-il, peut vite devenir un casse-tête si on n’en maîtrise pas bien la logique.
Pour faire un tableau d’avancement, il te faut :
- Une équation chimique équilibrée
- Les quantités de matière initiales (en mol)
- Les coefficients stœchiométriques
- Une bonne dose de rigueur et un zeste de logique !
Une fois construit, le tableau d’avancement permet de :
- Suivre quantitativement l’évolution des réactifs et des produits d’une réaction.
- Prédire l’état final : qui reste, qui disparaît ?
- Déterminer le réactif limitant et l’avancement maximal.
- Calculer les quantités finales de chaque espèce pour prévoir un rendement, dimensionner une synthèse ou répondre à une problématique concrète.
Il est composé de plusieurs lignes : état initial, état en cours de réaction (en fonction de l’avancement x), état final. Pour chaque espèce, chaque ligne détaille la quantité de matière présente à ce stade précis.
Construction pas à pas d’un tableau d’avancement
Démarche générale
Voici les étapes clés pour construire, compléter et exploiter un tableau d’avancement au bac.
Écrire l’équation chimique équilibrée
- Cette étape est indispensable : chaque erreur ici se répercute partout.
- Les coefficients stœchiométriques sont centraux pour calculer les variations de quantité de chaque espèce.
Exemple simple : la réaction entre le dihydrogène et le dioxygène pour former de l’eau :
2H2+O2⟶2H2O
Renseigner les quantités de matière initiales
- Calculer (ou indiquer si déjà donnée) la quantité de matière initiale pour chaque réactif et chaque produit, en utilisant :
- n=m/M pour les solides ou liquides purs (masse et masse molaire)
- n=C×V pour les solutions (concentration molaire et volume).
Créer le tableau sous forme structurée
Un modèle-type :
| États | Réactif A | Réactif B | Produit C | Produit D |
|---|---|---|---|---|
| Initial | n₀,A | n₀,B | 0 | 0 |
| Avancement x | n₀,A – a·x | n₀,B – b·x | c·x | d·x |
| Final | à calculer | à calculer | à calculer | à calculer |
- n₀,A et n₀,B : quantités initiales des réactifs A et B (en mol)
- a, b, c, d : coefficients stœchiométriques de l’équation chimique
- x : avancement de la réaction (en mol)
Exprimer les quantités à l’état intermédiaire et final
À l’état intermédiaire : pour chaque espèce
- Réactifs : n=n0−(coefficient stœchiométrique)×x
- Produits : n=(coefficient stœchiométrique)×x
À l’état final
On remplace x par xmax (si la réaction est totale)
ou par xf (si la réaction est non totale ou à l’équilibre).
Calculer l’avancement maximal xmax et le réactif limitant
L’avancement maximal est atteint lorsqu’un des réactifs est entièrement consommé.
Pour chaque réactif :
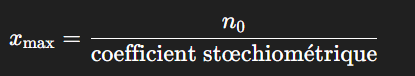
La plus petite valeur obtenue indique le réactif limitant.
Calculer les quantités finales
- Réinjecter xmax dans le tableau pour trouver les quantités à l’état final.

Exemple guidé
Supposons la réaction : HCl (aq)+NaOH (aq)⟶ NaCl (aq)+H2O (l)
On dispose de 0,020 mol de HCl et 0,015 mol de NaOH dans des volumes identiques.
| États | HCl | NaOH | NaCl | H₂O |
|---|---|---|---|---|
| Initial | 0,020 | 0,015 | 0 | 0 |
| Avancement x | 0,020-x | 0,015-x | x | x |
| Final | 0,020-xmax | 0,015-xmax | xmax | xmax |
- Calcul de xmax :
- Pour HCl :
xmax = 0,020 - Pour NaOH :
xmax = 0,015
- Pour HCl :
- Le plus petit est xmax = 0,015 : NaOH est limitant.
| États | HCl | NaOH | NaCl | H₂O |
|---|---|---|---|---|
| Final | 0,005 | 0 | 0,015 | 0,015 |
Les grandes utilités du tableau d’avancement
- Déterminer le réactif limitant (et donc faire des économies dans l’industrie !)
- Calculer le rendement d’une synthèse,
- Travailler sur des réactions en chaîne, des titres de solution, etc.
- Vérifier la conservation de la matière et de la charge (stœchiométrie)
- Naviguer entre solide, gaz, dissolution, précipitation, réactions d’oxydo-réduction, etc.
Les pièges à éviter absolument
Oublier d’équilibrer l’équation chimique
- Une équation mal équilibrée fausse tout le tableau et rend impossible l’identification du réactif limitant.
Confondre quantités de matière et masses / volumes
- Toujours tout ramener à la mole pour le tableau d’avancement, quelle que soit la forme initiale (volume, masse…).
- Utilise les relations n=m/M et n=C×V sans négliger les unités.
Mélanger les phases ou oublier les espèces spectatrices
- N’inscrire que les espèces qui interviennent directement dans l’équation chimique. Les ions ou molécules qui n’évoluent pas (espèces spectatrices) n’apparaissent pas dans le tableau.
Mal identifier le réactif limitant (surtout avec coefficients ≠ 1)
- Toujours bien diviser la quantité initiale par le coefficient stœchiométrique pour chaque réactif : la plus petite valeur est le réactif limitant.
Utiliser des quantités intermédiaires fausses
- À chaque étape, ajuste les quantités de chaque espèce en fonction de l’avancement en respectant les signes (réactif : – x ; produit : + x).
- Erreur fréquente : ajouter x pour un réactif, alors qu’il faut l’enlever .
Négliger le domaine d’application du tableau
- Pour les réactions non totales : l’avancement final n’atteint pas xmax, il faudra des informations complémentaires.
- Le tableau s’applique aussi dans certains cas à l’équilibre chimique ou dans le cas d’excès d’un réactif.
Astuces et conseils : spécial bac
- Toujours débuter par l’équation équilibrée.
- Trace toujours le tableau sur papier avant de passer au calcul numérique.
- Vérifie vos unités à chaque étape.
- Remplir systématiquement la colonne initiale, l’état d’avancement général puis l’état final.
- Calculer l’avancement maximal pour chaque réactif, identifier le limitant et n’utiliser que sa valeur dans la ligne finale.
- Relire et vérifier logiquement chaque ligne du tableau (masses, nombres, conservation globale).
- Utilise les couleurs pour visualiser réactif limitant/excédent, les états clés ou zones de risque.
Application avancée : taux d’avancement et réactions non totales
Le taux d’avancement τ est défini par le rapport :
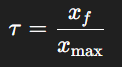
- Si τ=1 : la réaction est totale (les réactifs ont été consommés entièrement).
- Si τ<1 : la réaction est non totale, un équilibre chimique a été atteint.
Retiens bien ces informations, car dans les sujets bac, on peut te demander d’interpréter τ en lien avec un rendement, une conversion ou une discussion sur l’avancement réel par rapport au théorique.
Quiz : teste-toi comme au bac !
Associe chaque affirmation à la bonne réponse ou méthode :
- L’espèce qui s’épuise la première, c’est…
- Pour savoir combien de moles de produit D on obtient, il faut…
- Si le réactif limitant a pour coefficient 2 et que tu as mis 4 moles au départ, alors $x_{max}$ vaut…
- Pour chaque réactif, la quantité pendant la réaction s’exprime…
- Oublier d’équilibrer l’équation implique que votre tableau est…
a) Faux et inutilisable
b) n0−coefficient×x
c) 2
d) Le réactif limitant
e) Multiplier xmax par le coefficient de D
1-d, 2-e, 3-c, 4-b, 5-a
Ressources ludiques pour progresser
- Animations interactives : physique-chimie.ac-normandie.fr
- Fiche pratique et exercices corrigés : leon-blum.mon-ent-occitanie.fr
Conclusion
Maîtriser les tableaux d’avancement est autant une question de rigueur que de méthode scientifique. Cet outil te donne une vision instantanée et quantifiée de la réaction, des quantités en jeu, et du déroulement exact, tout en fournissant une structure universelle dans laquelle s’inscrire pour les résolutions d’exercices, les TP, les contrôles ou les futures pratiques en laboratoire. Savoir utiliser cet outil, c’est se doter d’un réflexe de chimiste rationnel autant qu’un atout indiscutable pour briller au bac et au-delà.
Entraîne-toi avec différents types d’équations, varie les scénarios (réactions totales, réactif en excès, précipitations, titrages, équilibres…) et, surtout, amuse-toi à remettre en question tes résultats pour progresser encore plus vite !