Bienvenue dans le monde fascinant de l’analyse spectrale ! Si vous préparez le bac ou voulez simplement comprendre la manière dont on « lit » un spectre IR (infrarouge) ou UV-visible (ultraviolet-visible), cet article va vous donner toutes les clés : méthode étape par étape, explications claires, illustrations visuelles, astuces pour éviter les pièges et quiz interactifs pour retenir l’essentiel. Prêt à devenir un pro de la spectroscopie ?
Pourquoi analyser un spectre ? La base en 2 minutes
L’analyse de spectre IR ou UV-visible permet :
- D’identifier une molécule grâce à ses « empreintes digitales » : chaque liaison ou groupement chimique absorbe à une longueur d’onde donnée.
- De repérer donc des fonctions chimiques (alcools, acides, doubles liaisons…).
- De vérifier la pureté et la structure d’un composé, très utile en chimie organique, au bac et au-delà.
Aperçu rapide : qu’est-ce qu’un spectre IR ? Un spectre UV-visible ?
Spectre IR (Infrarouge)
- Axe des abscisses : nombre d’ondes (en cm⁻¹, de 4000 à 400).
- Axe des ordonnées : % de transmission (ou absorbance).
- Ce qu’on cherche : les « creux » (bandes d’absorption) indiquant la présence de liaisons chimiques spécifiques.
Spectre UV-Visible
- Axe des abscisses : longueur d’onde (en nm, généralement 200-800 nm).
- Axe des ordonnées : absorbance.
- Ce qu’on cherche : les « pics » d’absorbance, synonymes de transitions électroniques (causés par les doubles liaisons, cycles aromatiques…).
Comment lire un spectre IR : la méthode pas à pas
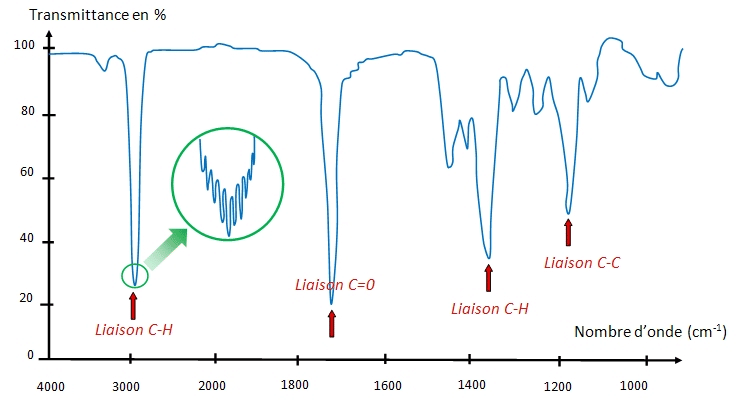
Étape 1 : Identification des grandes zones
| Zone | Nombre d’ondes (cm⁻¹) | Liaisons recherchées |
|---|---|---|
| 4000-2500 | H liés à C, N, O | -OH (alcool), -NH, -CH |
| 2500-2000 | Triple liaisons | -C≡C-, -C≡N |
| 2000-1500 | Doubles liaisons | C=O, C=C, C=N |
| 1500-400 | Empreinte digitale | Liaisons complexes |
Étape 2 : Reperer les pics caractéristiques
- O-H (alcool/ acide) : bande large vers 3200-3600 cm⁻¹
- N-H (amine) : pic moyen à 3300 cm⁻¹
- C=O (carbonyle) : pic fort, fin à 1680-1750 cm⁻¹
- C-H (alcanes, alkenes) : 2850-3100 cm⁻¹
- C≡N, C≡C : vers 2100-2260 cm⁻¹ (plus rarement rencontré)
- C=C (aromatique) : 1500-1600 cm⁻¹
💡 À noter que : la région 1500-400 cm⁻¹, dite « empreinte digitale », est spécifique à chaque molécule.
Étape 3 : Interpréter l’ensemble
- Comparez les bandes présentes à un tableau de correspondance.
- Repérez l’absence (ou la présence) de certains pics, ce qui permet d’éliminer/valider des fonctions chimiques.
Comment lire un spectre UV-visible : la méthode infaillible
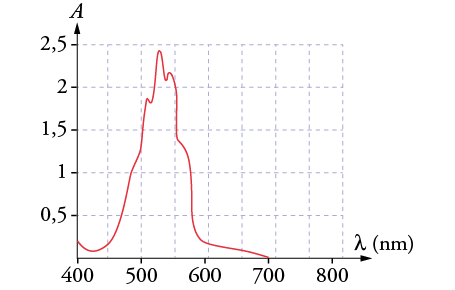
Étape 1 : Trouver les pics d’absorbance
- Un maximum d’absorbance (λmax) correspond à la transition électronique la plus énergique (souvent un chromophore, ex : cycle aromatique).
- Largeur, forme et nombre de pics renseignent sur la complexité du chromophore.
Étape 2 : Identifier les longueurs d’onde absorbées
| Zone du spectre | Type de groupe absorbant | Exemple |
|---|---|---|
| 200-400 nm | transitions π→π* | Doubles liaisons, cycles aromatiques |
| 400-800 nm | transitions n→π* | NO₂, C=O (groupe carbonyle), azote, etc. |
Étape 3 : Corréler avec la couleur apparente
- La couleur d’une substance est complémentaire de celle absorbée.
- Par exemple : pic d’absorbance à 500 nm (vert) ⇒ solution apparaît rouge (sa couleur complémentaire).
Astuces pour l’examen : erreurs classiques et réflexes gagnants
Pour te préparer
- Préparez des fiches-mémo avec 10 bandes IR et 10 liaisons types UV-visible à retenir.
- Entraînez-vous à repérer « le détail qui tue » : une absence ou une bande large inédite.
- Variez les exemples : comparez l’éthanol, l’acide acétique, le benzène, etc.
- Faites des quiz réguliers (Kartable, Annabac, FichesBac).
Le jour J
- Toujours examiner d’abord le spectre IR (plus simple pour fixer les grandes fonctions).
- Ne jamais confondre absorption large (souvent O-H/N-H, forte association hydrogène) et absorption fine (C=O, C=C).
- Pour l’UV-visible, raisonner avec la couleur absorbé/observé (antijeu chromatique).
- Utiliser les tables de correspondance fournies dans les sujets.
- Vérifier la consistance avec la formule brute ou semi-développée donnée.
Quiz interactif : Es-tu prêt pour l’examen ?
- Dans un spectre IR, que signifie une bande fine et intense à 1715 cm⁻¹ ?
- Sur un spectre UV-visible, un pic à 420 nm correspond à la couleur absorbée jaune. Quelle couleur verra-t-on à l’œil nu ?
- Le manque de pic près de 3300 cm⁻¹ sur un IR indique-t-il la présence ou non d’un groupe -OH ?
- Si un spectre UV-visible montre un maximum à 275 nm, la molécule paraît-elle colorée ?
À toi de jouer ! Les réponses sont en fin d’article.
Je te conseille vivement de te tester aussi avec ce quiz pour solidifier tes connaissances !
Où pratiquer ? Où trouver des spectres pour t’entraîner ?
- SpectraBase (spectrabase.com) : vaste base de spectres IR et UV-vis réels, intuitifs.
- ChemLibreTexts : sections « Spectroscopy », explications et exemples concrets pour chaque spectre.
- YouTube – « Spectre IR Correction bac », « Lire un spectre UV-visible » : exercices vidéo étape par étape.
- Sciences à l’épreuve du bac – Annales corrigées avec explications sur l’analyse de spectres.
Tableaux de correspondance
Voici deux tableaux de correspondance utiles pour interpréter les spectres IR et UV-visible en physique-chimie :
A) IR : Bandes d’absorption caractéristiques
La spectroscopie IR détecte les vibrations des liaisons chimiques. Les pics sont exprimés en nombre d’onde (cm⁻¹).
| Liaison/Fonction | Position (cm⁻¹) | Caractéristique |
|---|---|---|
| O-H alcool | 3200-3600 | Large, forte |
| N-H amines/amides | 3300 | Moyenne, fine |
| C=O carbonyle | 1680-1750 | Fine, forte |
| C=C aromatique | 1500-1600 | Fine, variable |
| C-H | 2850-3100 | Multiples |
| C≡N, C≡C | 2100-2260 | Moyennes, fines |
B) UV-visible : Longueur d’onde des transitions
Ce tableau te permettra d’identifier des composés selon leur absorption de lumière dans l’ultraviolet (200–400 nm) et le visible (400–800 nm).
| Groupe chromophore | λmax typique (nm) |
|---|---|
| Benzène, aromatiques | 255-275 |
| Diene conjugué | 220-270 |
| Carbonyle | 270-310* |
| Nitro/aide azotée | 350-400 |
| Pigments colorés | >400 |
Réponses du quiz
- Correspond à une fonction carbonyle (C=O), typique d’un cétone, acide ou ester.
- La couleur complémentaire du jaune (420 nm) étant le violet, la solution apparaîtra violette à l’œil nu.
- L’absence de pic près de 3300 cm⁻¹ suggère l’absence d’un groupe -OH (ou -NH).
- Non, le maximum à 275 nm est dans l’UV : la molécule est invisible à l’œil, donc incolore.
L’essentiel : lire entre les pics
L’analyse des spectres IR et UV-visible est une compétence essentielle pour identifier et caractériser les molécules en chimie, notamment lors du bac. Le spectre IR permet d’identifier précisément les groupements fonctionnels grâce à leurs bandes d’absorption caractéristiques, véritables « empreintes digitales » moléculaires. Le spectre UV-visible, quant à lui, renseigne sur les transitions électroniques, souvent liées à la présence de doubles liaisons ou de cycles aromatiques, et explique la couleur des substances observées. Maîtriser la lecture de ces spectres, en comprenant où chercher les pics et ce qu’ils signifient, permet de mieux détourer la structure d’un composé et d’éviter les erreurs d’interprétation.