Tu connais peut-être déjà la formule brute d’un composé organique, comme C4H10O. Mais sais-tu que cette même formule peut représenter plusieurs molécules différentes, aux propriétés physiques, chimiques, voire biologiques distinctes ? C’est ici qu’interviennent les isomères, ces variantes moléculaires qui partagent la même composition atomique mais diffèrent par leur structure ou leur agencement.
Dans cet article, on va plonger ensemble dans deux catégories fondamentales d’isomères en chimie organique : les isomères de fonction et les isomères de chaîne. Tu découvriras comment ces variations influent sur la nature même du composé, comment les identifier et les différencier, et pourquoi cette notion est essentielle pour comprendre la richesse de la chimie organique et ses applications.
Les isomères en chimie organique : définitions et enjeux
Qu’est-ce qu’un isomère ?
Un isomère est une molécule qui possède la même formule brute qu’une autre mais une structure différente, ce qui modifie ses propriétés. En chimie organique, la formule brute te dit le nombre et le type d’atomes, mais pas comment ils s’organisent dans l’espace.
Les isomères sont classés en plusieurs types, dont les plus étudiés en terminale sont :
- Les isomères de chaîne : qui diffèrent par l’agencement linéaire ou ramifié de la chaîne carbonée.
- Les isomères de fonction : qui possèdent des groupes fonctionnels différents, donc appartiennent à des familles chimiques distinctes (alcools, éthers, cétones, aldéhydes, etc.).
Ces distinctions sont capitales car elles bouleversent complètement les caractéristiques du composé, sa réactivité, son usage, voire sa toxicité.
Les isomères de chaîne : jouer avec la forme de l’ossature carbonée
Comprendre la structure carbonée
La chaîne carbonée est la colonne vertébrale de la molécule organique. Elle peut être linéaire (en ligne droite) ou ramifiée (avec des ramifications, des « branches »). Cette organisation influe sur la molécule entière.
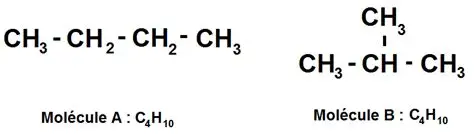
Par exemple, pour la formule brute C4H10 on obtient deux isomères de chaîne :
- Le butane, une chaîne linéaire de 4 carbones.
- Le 2-méthylpropane (ou isobutane), une chaîne ramifiée avec 3 carbones principaux et une ramification méthyle sur le deuxième carbone.
Conséquences sur les propriétés
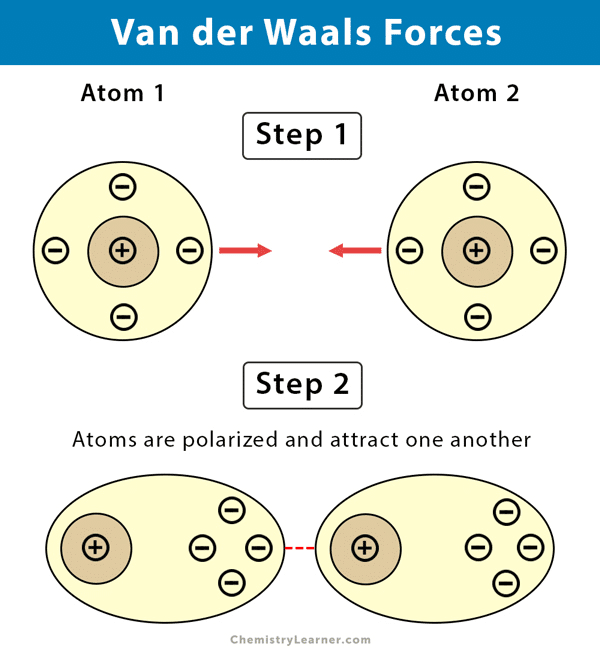
La ramification modifie la température d’ébullition, la densité, la solubilité, et même la réactivité. Par exemple, le butane a un point d’ébullition plus élevé que l’isobutane, car la chaîne linéaire favorise des forces de Van der Waals plus importantes.
Placer des exemples visuels
- Dessine la formule développée du butane et de l’isobutane pour bien visualiser les différences.
- Montre la formule semi-développée en insistant sur l’emplacement de la ramification.
Les isomères de fonction : la diversité au cœur de la formule
Qu’est-ce qu’une fonction chimique ?
Le groupe fonctionnel est la partie d’une molécule organique qui détermine ses propriétés chimiques majeures. Changer de groupe fonctionnel, même en gardant la formule brute, produit des isomères de fonction.
Exemples classiques d’isomères de fonction
Pour la formule brute C2H6O, on peut avoir :
- L’éthanol (alcool) : CH3−CH2−OH
- L’éther diméthylique (éther) : CH3−O−CH3
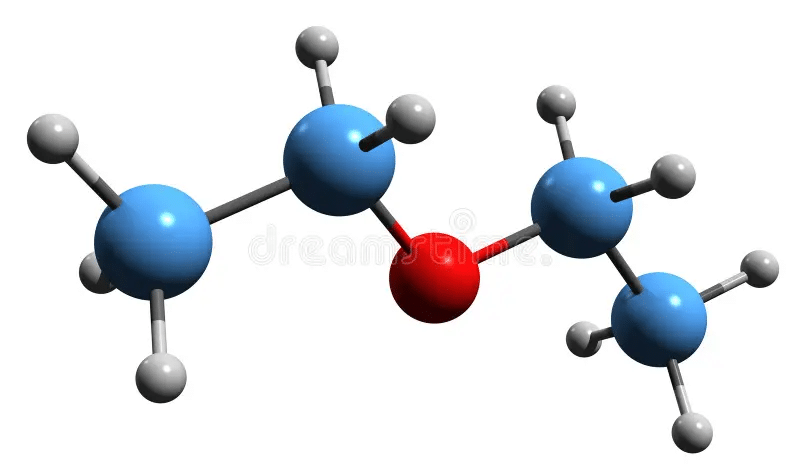
Les deux composés ont la même formule brute, mais des propriétés chimiques très différentes : l’éthanol est un liquide polaire, miscible à l’eau. Quant à l’éther, il est moins polaire, volatil et inflammable.
Pourquoi cette distinction est-elle importante ?
- Les isomères de fonction ont des réactivités différentes, puisqu’ils appartiennent à des familles chimiques différentes.
- Les applications industrielles ou pharmaceutiques varient selon la fonction.
- La spectroscopie et d’autres techniques analytiques permettent d’identifier la fonction chimique présente.
Identifier et différencier les isomères : méthodes et outils
Méthodes analytiques
- Spectroscopie infrarouge (IR) : détecte les groupes fonctionnels par leurs vibrations caractéristiques (ex : bande O–H vers 3300 cm⁻¹ pour les alcools).
- Réactivité chimique : tester la réaction du composé avec des réactifs ciblés (ex : réaction avec l’acide chlorhydrique).
- Spectrométrie de masse et RMN (Résonance Magnétique Nucléaire) : fournissent des informations détaillées sur la structure.
Utilisation des règles de nomenclature
Savoir nommer correctement les isomères aide à leur reconnaissance : symptômes intégrés dans la nomenclature IUPAC révèlent la nature du groupe fonctionnel et l’agencement carboné.
L’intérêt fondamental des isomères en chimie organique
En chimie fondamentale
En chimie fondamentale, la notion d’isomérie joue un rôle essentiel en dévoilant la diversité moléculaire qui émerge à partir d’un nombre limité d’atomes. Cette diversité, bien que structurée sur des bases simples, offre un éventail de possibilités infinies, permettant la création de molécules aux propriétés uniques. L’isomérie est ainsi la clé pour comprendre la relation structure-fonction, un concept central qui lie la configuration d’une molécule à son comportement, à ses interactions et à ses effets dans des contextes spécifiques, comme en biologie ou en médecine. Cette relation est le fondement de la chimie organique avancée, où chaque changement, aussi minime soit-il, dans l’arrangement des atomes peut engendrer des propriétés radicalement différentes.
L’étude de l’isomérie permet donc d’explorer de nouvelles molécules, ou encore de concevoir des matériaux innovants.
En industrie et santé
La synthèse pharmaceutique illustre parfaitement l’importance des isomères dans le développement de médicaments. En effet, certains isomères peuvent posséder des activités thérapeutiques radicalement opposées, un phénomène particulièrement observé chez les épimères.
Ces molécules, bien que similaires dans leur structure, se différencient par l’orientation d’un seul groupe fonctionnel, et cette petite variation peut avoir un impact majeur sur leur efficacité ou leur toxicité dans le traitement de diverses pathologies.
Dans le domaine des matériaux et des polymères, la structure moléculaire de base joue un rôle déterminant dans les propriétés physiques, telles que la rigidité, la flexibilité ou la conductivité. C’est cette même structure qui permet de concevoir des matériaux aux caractéristiques précises, adaptées à des applications spécifiques, qu’il s’agisse de plastiques, de caoutchoucs ou de fibres.
Dansl’agro-alimentaire et la parfumerie, la structure moléculaire d’une substance est également essentielle : les odeurs, les goûts et même les textures des produits sont étroitement liés à la manière dont les atomes sont arrangés dans les molécules. Par exemple, des variations dans la configuration d’une molécule peuvent transformer une saveur douce en une saveur amère ou influencer la perception d’un parfum, démontrant ainsi le lien entre la structure chimique et les expériences sensorielles.
Ainsi, que ce soit dans la médecine, la science des matériaux ou l’industrie du luxe, la structure moléculaire est le fil conducteur qui lie la théorie à la pratique, façonnant des produits aux propriétés uniques.
Quiz : testons ta compréhension !
- Que signifie isomères de fonction ? Donne un exemple avec une formule brute.
- Qu’est-ce qu’un isomère de chaîne ? Cite les deux isomères de C4H10C_4H_{10}C4H10.
- Comment la ramification affecte-t-elle les propriétés d’un hydrocarbure ?
- Quelle différence importante existe-t-il entre un alcool et un éther ?
- Pourquoi la spectroscopie IR est utile pour différencier les isomères ?
Réponses :
- Molécules ayant la même formule, mais des groupes fonctionnels différents : Par exemple, l’éthanol et l’éther diméthylique ont la même formule chimique (C2H6O), mais des groupes fonctionnels distincts.
- Isomères avec chaînes carbonées différentes : Le butane (linéaire) et le 2-méthylpropane (ramifié) sont des isomères ayant des chaînes carbonées différentes.
- Effet sur les propriétés physiques : La présence de groupes fonctionnels modifie le point d’ébullition et d’autres propriétés physiques, telles que la solubilité.
- Différences entre alcool et éther : L’alcool possède un groupe –OH, tandis que l’éther a une liaison C–O–C. Cela influe sur la polarité et la réactivité des molécules.
- Importance de la méthode : Elle permet de mettre en évidence la présence ou l’absence de groupes fonctionnels caractéristiques, comme O–H ou C=O.
Conclusion : La beauté cachée des molécules
Derrière chaque formule brute, la chimie organique réserve une infinité de surprises grâce aux isomères. Que ce soit par la forme de la chaîne carbonée ou par la nature du groupe fonctionnel, ces variations modifient, parfois radicalement, les propriétés et utilisations des composés. En maîtrisant les isomères de chaîne et de fonction, tu gagnes la capacité d’interpréter, de prédire et de comprendre la diversité moléculaire du monde vivant et industriel.