Imagine-toi chimiste, face à une réaction chimique, devoir anticiper combien de réactifs sont nécessaires pour obtenir une certaine quantité de produit, ou au contraire, combien de produit tu peux espérer selon ce que tu as en stock. C’est justement là que la stœchiométrie entre en scène : cette discipline clef de la chimie, loin d’être un simple calcul fastidieux, est un véritable langage qui relie nombres, masses, volumes et molécules dans une harmonie précise.
Dans cet article, tu vas découvrir comment utiliser la stœchiométrie pour prévoir toutes les quantités impliquées dans une réaction chimique, à partir de l’équation chimique. Au-delà des formules, tu comprendras pourquoi ces notions sont fondamentales pour maîtriser ta matière, réussir tes expériences ou simplement saisir la dynamique moléculaire qui régit l’univers.
La stœchiométrie : qu’est-ce que c’est au juste ?
Définitions et principes clés
La stœchiométrie (du grec stoicheion (élément) et metron (mesure)) signifie littéralement la « mesure des éléments ». C’est l’étude quantitative des relations entre les quantités de matière des réactifs et des produits dans une réaction chimique. Elle répond à la question : « combien ? »
Elle repose avant tout sur deux piliers :
- La conservation de la matière : dans une réaction chimique, la masse totale se conserve, les atomes se réarrangent mais ne disparaissent pas.
- L’équation chimique équilibrée : elle indique les proportions exactes des espèces chimiques qui réagissent et se forment.

Le rôle central de l’équation chimique
L’équation chimique est la photographie abstraite d’une réaction : elle te montre quels réactifs se transforment et en quels produits, avec des coefficients numériques précis donnant les proportions.
Par exemple, pour la combustion du méthane :
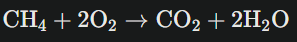
Cette équation te dit que 1 molécule (ou 1 mole) de méthane réagit avec 2 moles d’oxygène pour produire 1 mole de dioxyde de carbone et 2 moles d’eau.
Ces coefficients sont la base du calcul stœchiométrique.
Préparer les calculs : bien manipuler la quantité de matière
La notion de mole
La stœchiométrie travaille essentiellement avec la quantité de matière exprimée en moles (notée n), une unité qui contient toujours un nombre fixe d’entités, appelé le nombre d’Avogadro (≈ 6,02 × 10²³). Cela te permet de passer des microcosmes atomiques aux quantités mesurables en laboratoire.
Conversion masse ↔ quantité de matière
Pour utiliser la stœchiométrie, il te faut souvent convertir des masses mesurées en quantités de matière. La formule clé est : n=m/M
où
- n = quantité de matière (mol),
- m = masse en grammes (g),
- M = masse molaire (g/mol).
Exemple : 16 g de méthane ⇒n=16/16=1 mole.
Autres conversions utiles
Selon le contexte, tu pourras aussi manipuler les volumes (pour les gaz à conditions normales, 1 mole = 22,4 L) ou les concentrations en solution (molarité C=n/V).
L’art du calcul stœchiométrique : étapes et méthode
Étape 1 : équilibrer correctement l’équation chimique
Un équilibre parfait est indispensable pour que tous les calculs soient valides. Vérifie que les atomes de chaque élément sont présents en nombre égal des deux côtés.
Étape 2 : exprimer les quantités connues en moles
Convertis les masses, volumes ou concentrations données en quantité de matière.
Étape 3 : utiliser les ratios stœchiométriques pour trouver les inconnues
Utilise la proportionnalité entre coefficients de l’équation pour calculer la quantité de matière du produit ou du réactif recherché.
Par exemple, si tu as 2 moles d’oxygène dans la combustion du méthane, alors :
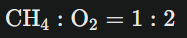
donc tu peux réagir une mole de méthane.
Étape 4 : convertir la quantité calculée en la grandeur désirée
Souvent, on termine les calculs en transformant la quantité de matière en masse, volume, ou concentration selon le type de problème.
Cas d’études concrets pour s’entrainer
Exemple 1 : Combustion du propane
Équation : C3H8+5O2→3CO2+4H2O
Combien de grammes d’oxygène sont nécessaires pour brûler complètement 44 g de propane ?
- Masse molaire C3H8=44 g/mol, donc nC3H8=44/44=1 mol.
- Selon équation, 1 mole propane réagit avec 5 moles O2.
- Masse molaire O2=32 g/mol.
- Masse nécessaire d’oxygène : 5×32=160g.
Exemple 2 : Réaction en solution
Réaction de neutralisation : HCl+NaOH→NaCl+H2O
Combien de volume de solution d’acide chlorhydrique 0,1 mol/L est nécessaire pour neutraliser 25 mL d’hydroxyde de sodium 0,2 mol/L ?
- Quantité de matière NaOH=C×V=0,2×0,025=5×10−3 mol.
- Selon équation, nHCl=nNaOH=5×10−3 mol.
- Volume V=n/C=5×10−3/0,1=0,05 L=50 mL.
Cas particuliers et astuces
- Réactif limitant : celui qui s’épuise en premier, déterminant la quantité maximale de produit formé.
- Rendement : production réelle souvent inférieure à la théorie, il faut l’introduire dans les calculs via un pourcentage.
- Réactions multiples : parfois, plusieurs réactions se déroulent simultanément, il faut décomposer les calculs.

Pourquoi maîtriser la stœchiométrie ? Applications et enjeux
Laboratoire et industrie
La stœchiométrie assure la justesse des dosages, optimise la consommation de réactifs, minimise les déchets et maîtrise la sécurité des processus.

Environnement
Elle permet de prévoir les polluants produits, la qualité de l’air et de l’eau, et guide les traitements.
Santé et biologie
Elle aide à comprendre les dosages médicamenteux, les bilans métaboliques, la chimie des enzymes.
Quiz interactif : teste ta maîtrise !
- Quelle est la première étape indispensable avant de faire un calcul stœchiométrique ?
- Si tu as 2 moles de H2 et 1 mole de O2, combien de moles d’eau peux-tu théoriquement produire ?
- Calcule la quantité de matière dans 18 g d’eau (H2O, M=18 g/mol).
- Pourquoi le concept de réactif limitant est-il crucial ?
- Dans la réaction 2Na+Cl2→2NaCl, combien de moles de NaCl produiras-tu à partir de 3 moles de Na ?
Réponses :
- Équilibrer l’équation chimique.
- Avec 2 moles H2, il faut 1 mole O2 pour produire 2 moles d’eau (donc tu peux produire 2 moles d’eau).
- n=18/18=1 mole.
- Il désigne le réactif qui limite l’avancement de la réaction car il s’épuise en premier.
- 3 moles de Na produisent 3 moles de NaCl (relation molaire 1:1).
Ressources pour aller plus loin
- Outils interactifs : simulateurs PhET « Reaction Stoichiometry ».
- Vidéos pédagogiques sur YouTube : chaines « ScienceEtonnante », « ChimieMooc ».
Conclusion : la stœchiométrie, ta carte au trésor chimique
Maîtriser la stœchiométrie, c’est apprendre à parler le langage secret de la matière, anticiper les transformations, calculer avec précision et gagner en confiance en laboratoire comme dans les examens. Au-delà des chiffres, elle incarne cette élégance des équilibres et la rigueur des lois qui régissent notre univers moléculaire.