Imagine-toi face à deux solutions incolores : l’une contient du vinaigre (acide acétique), l’autre de l’acide chlorhydrique. À l’œil nu, impossible de les distinguer. Pourtant, l’une pourrait simplement parfumer ta salade, tandis que l’autre te brûlerait gravement la peau. Ce qui fait toute la différence réside dans un concept fondamental de la chimie : la constante d’acidité et son expression logarithmique, le pKa. Ces grandeurs, loin d’être de simples abstractions mathématiques, gouvernent les équilibres chimiques qui régissent ta physiologie, l’environnement, l’industrie et même la gastronomie.
Comment ces nombres « magiques » permettent-ils de quantifier la force d’un acide ? Pourquoi sont-ils si cruciaux pour comprendre le monde qui t’entoure ?
Genèse conceptuelle de la constante d’acidité : de l’observation à la quantification
L’équilibre dynamique en solution aqueuse
Lorsqu’un acide faible comme l’acide acétique (CH₃COOH) plonge dans l’eau, il ne se dissocie pas complètement. Contrairement à un acide fort qui « abandonne » tous ses protons, l’acide faible établit un équilibre dynamique entre sa forme moléculaire et sa forme ionisée. Cette « hésitation » moléculaire s’exprime par l’équation :
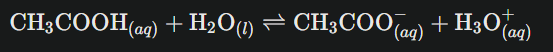
À tout instant, certaines molécules cèdent leur proton tandis que d’autres le récupèrent. Ce « va-et-vient » protonique atteint finalement un état d’équilibre où les vitesses de réaction dans les deux sens s’égalisent.
Naissance de la constante d’acidité
Pour quantifier cette tendance à la dissociation, les chimistes ont défini la constante d’acidité Ka. Cette grandeur sans dimension exprime mathématiquement l’aptitude d’un acide à céder ses protons selon l’expression :
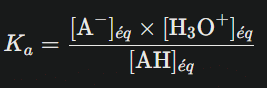
où [A⁻], [H₃O⁺] et [AH] représentent respectivement les concentrations molaires à l’équilibre de la base conjuguée, des ions hydronium et de l’acide non dissocié.
Le pKa : une échelle logarithmique révolutionnaire
Pourquoi « p » devant Ka ?
Les valeurs de Ka s’étalent sur plusieurs ordres de grandeur, allant de 10⁻¹⁵ pour les acides les plus faibles à 10⁶ pour les plus forts. Manipuler de tels nombres devient vite fastidieux. C’est pourquoi les chimistes ont adopté une notation logarithmique similaire à celle du pH : pKa=−log(Ka)
Cette transformation logarithmique compresse l’échelle et la rend ainsi plus lisible. Ainsi, un Ka de 10⁻⁵ devient un pKa de 5, bien plus maniable.
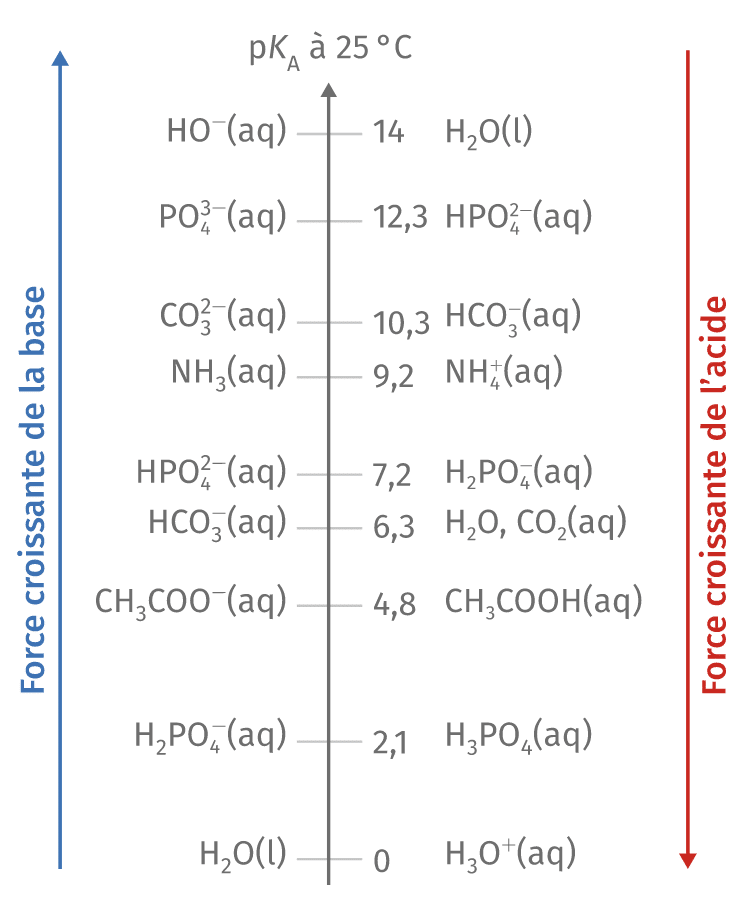
Échelle des pKa : un thermomètre de la force acide
L’échelle des pKa fonctionne à l’inverse de l’intuition première : plus le pKa est faible, plus l’acide est fort. Cette logique s’explique aisément : un acide fort possède un Ka élevé (dissociation importante), donc un pKa faible. À l’inverse, un acide faible présente un Ka petit (dissociation limitée) et donc un pKa élevé.
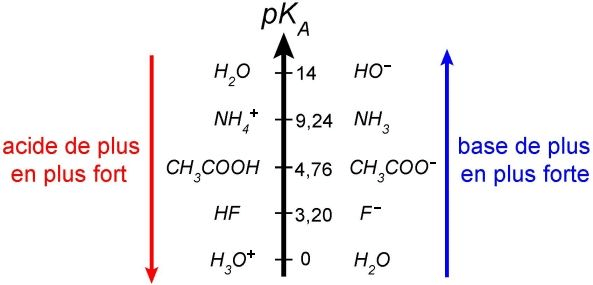
En solution aqueuse, cette échelle s’étend approximativement de -10 à +15, avec des repères fondamentaux :
- pKa ≈ 0 : limite entre acides forts et faibles
- pKa = 7 : neutralité relative
- pKa ≈ 14 : limite entre bases faibles et fortes
Applications concrètes : quand les nombres prennent vie
Prédire la force relative des acides
Considérons deux acides organiques courants : l’acide formique (HCOOH, pKa = 3,8) et l’acide acétique (CH₃COOH, pKa = 4,8). Le pKa plus faible de l’acide formique indique qu’il se dissocie davantage que l’acide acétique dans des conditions identiques. Concrètement, cela signifie qu’une solution d’acide formique à 0,1 mol/L aura un pH plus bas qu’une solution d’acide acétique à la même concentration.
Relation pH-pKa : l’équation de Henderson-Hasselbalch
La relation fondamentale qui lie pH et pKa s’écrit :
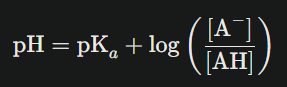
Cette équation, connue sous le nom d’équation de Henderson-Hasselbalch, révèle que :
- Quand pH = pKa, les concentrations [A⁻] et [AH] sont égales
- Quand pH < pKa, la forme acide AH prédomine
- Quand pH > pKa, la forme basique A⁻ prédomine
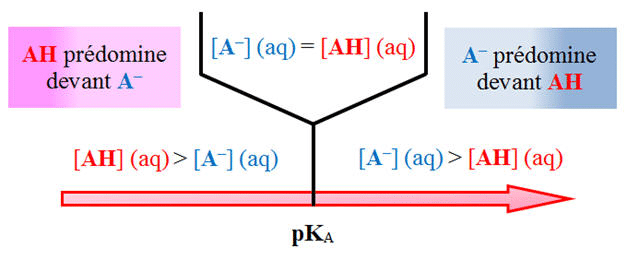
Diagrammes de prédominance : cartographier les équilibres
Construction et interprétation
Les diagrammes de prédominance constituent des outils visuels puissants pour représenter l’évolution des espèces en fonction du pH. Pour un couple acide-base, on trace généralement :
- L’axe horizontal représentant le pH (0 à 14)
- La droite verticale au niveau pH = pKa délimitant les zones de prédominance
- À gauche de pKa : prédominance de la forme acide
- À droite de pKa : prédominance de la forme basique
Applications en biochimie
Ces diagrammes trouvent leurs applications les plus spectaculaires en biochimie. Le maintien du pH sanguin autour de 7,4 repose sur l’équilibre du couple acide carbonique/hydrogénocarbonate (H₂CO₃/HCO₃⁻, pKa = 6,4). À pH 7,4, la forme HCO₃⁻ prédomine largement, ce qui explique l’efficacité du « tampon bicarbonate » dans notre organisme.
Facteurs d’influence et limites conceptuelles
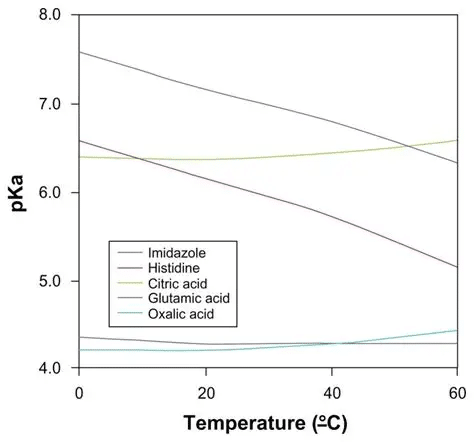
Effet de la température
La constante Ka, et donc le pKa, dépend de la température. Cette dépendance s’explique par l’influence thermique sur les équilibres chimiques selon le principe de Le Chatelier. Pour l’eau pure par exemple, le pKw (produit ionique de l’eau) passe de 14,0 à 25°C à 13,3 à 50°C.
Influence du solvant
Le concept de pKa tel que présenté ici s’applique strictement aux solutions aqueuses. Dans d’autres solvants, les valeurs peuvent considérablement changer. Un acide fort dans l’eau peut devenir faible dans un solvant moins polaire, illustrant le caractère relatif de la force acide.
Force ionique et activité
Dans les solutions concentrées, les interactions électrostatiques entre ions modifient l’« activité » des espèces chimiques. Les calculs précis nécessitent alors de remplacer les concentrations par les activités, introduisant des coefficients correctifs qui complexifient les calculs.
Méthodologie de calcul : de la théorie à la pratique
Calcul direct du pKa à partir de mesures expérimentales
Pour déterminer expérimentalement le pKa d’un acide faible, plusieurs méthodes s’offrent au chimiste :
- Méthode de la demi-neutralisation : lors du titrage d’un acide faible par une base forte, le pH au point de demi-équivalence égale directement le pKa
- Méthode conductimétrique : en mesurant la conductivité de solutions d’acide à différentes concentrations
- Méthode spectrophotométrique : en suivant l’évolution des spectres d’absorption des formes acide et basique.
Résolution d’exercices types
Prenons un exemple concret : une solution d’acide benzoïque (C₆H₅COOH) de concentration 0,1 mol/L présente un pH de 2,6. Comment calculer son pKa ?
Étape 1 : Calcul de la concentration en ions hydronium
La concentration en ions hydronium (H3O+) est donnée par la relation suivante, où la pH est égal à 2,6 :
[H3O+]=10−pH=10−2,6=2,5×10−3 mol/L
Étape 2 : Application de l’électroneutralité et des équilibres
Pour un acide faible, on suppose que :

Étape 3 : Calcul de la constante d’acidité Ka et de son pKa
La constante d’acidité Ka est calculée en utilisant l’expression de l’équilibre pour un acide faible :
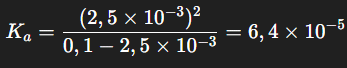
Ensuite, le pKa est déterminé par la formule :
pKa=−log(6,4×10−5)=4,2
Ressources interactives : pour aller plus loin
Pour visualiser concrètement l’évolution des concentrations avec le pH :
- Simulateurs PhET Colorado (« Acid-Base Solutions ») : manipulation virtuelle de solutions acides et basiques
Quiz interactif : consolide tes acquis !
- Définition conceptuelle : Qu’exprime fondamentalement la constante d’acidité Ka d’un couple acide-base ?
- Calcul numérique : L’acide lactique présente un pKa de 3,9. Calcule sa constante Ka.
- Comparaison qualitative : Entre l’acide formique (pKa = 3,8) et l’acide cyanhydrique (pKa = 9,2), lequel est le plus fort ? Justifie.
- Application physiologique : Pourquoi le pKa du couple H₂CO₃/HCO₃⁻ (6,4) en fait-il un excellent tampon sanguin à pH 7,4 ?
- Prédiction : Une solution équimolaire d’acide acétique et d’acétate de sodium présente-t-elle un pH acide, neutre ou basique ? (pKa acide acétique = 4,8)
Réponses :
- Ka quantifie la tendance d’un acide à céder ses protons en solution aqueuse, traduisant l’équilibre entre forme dissociée et non dissociée.
- Ka = 10^(-pKa) = 10^(-3,9) = 1,26 × 10^(-4)
- L’acide formique est plus fort car son pKa est plus faible (3,8 < 9,2), indiquant une dissociation plus importante.
- À pH 7,4, soit pKa + 1, le rapport [HCO₃⁻]/[H₂CO₃] vaut 10^1 = 10. La base conjuguée prédomine largement, permettant de « tamponner » efficacement les apports acides.
- pH basique (≈ 9,4). Dans un mélange équimolaire acide faible/base conjuguée, pH = pKa + log(1) = pKa = 4,8… Non ! Erreur : le pH d’un tel tampon égale exactement le pKa, soit 4,8 (légèrement acide).
Conclusion
La constante d’acidité et le pKa dépassent largement le cadre des exercices scolaires. Ces grandeurs fondamentales permettent de prédire les réactions, d’optimiser les synthèses, de comprendre les mécanismes biologiques et de concevoir des médicaments. Du pH de ton estomac (≈ 1,5) régulé par l’acide chlorhydrique au fonctionnement des enzymes dont l’activité dépend crucialement du pH du milieu, ces concepts irriguent l’ensemble des sciences du vivant et de la matière.
Maîtriser Ka et pKa, c’est détenir les clés de compréhension des équilibres qui gouvernent notre monde chimique. Ces « nombres magiques » révèlent comment la nature organise ses transformations, comment ton organisme maintient ses équilibres vitaux, et comment l’industrie optimise ses procédés. Une véritable fenêtre ouverte sur l’intimité moléculaire de l’univers !